서론
치아우식증은 치의학의 발달에도 불구하고 치주질환과 더불어 구강병의 양대 질환으로 다양한 연령층에서 문제점을 야기하고 있다[1]. 치아우식증은 구강 내 상주하는 세균 중 Streptococcus mutans(S. mutans)가 우식증을 일으키는 중요한 원인균으로 탄수화물 대사 작용으로 산을 생성하여 치아 표면에 부착하고 법랑질을 탈회하여 우식증을 유발한다[2,3]. 이러한 치아우식증을 예방하기 위해 치면세균막조절, 불소이용, 식이조절, 잇솔질교육, 치면열구전색재 수복 등 다양한 방법이 있으며 이 중에서 가장 효과적인 예방법이 치면열구전색재 수복이다[4,5]. 우식증의 발생 빈도가 높은 부위는 치아의 형태학적 특징인 깊은 소와와 열구가 존재하는 교합면 부위다. 이러한 특징은 구강 내 미생물과 음식물잔사 저류의 장소를 제공하고 단순한 기계적 방법으로 제거가 어려우며 국소적인 불소이용은 평활면에는 효과적이나 교합면 부위의 우식예방 효과에는 미흡하다[4,6]. 치면열구전색재는 1967년에 소개된 이후 수복 빈도가 꾸준히 증가하였으며 우식증 예방효과는 65-90% 이상으로 보고되고 있다[5,7,8]. 치아우식증은 개인뿐만 아니라 사회적으로 큰 비용 부담이 되는 중요 질환이며 이에 정부에서는 치아우식 예방사업으로 치면열구전색을 보험 급여화하여 지원하고 있다[9]. 실제로 초기 치아우식증이 존재하는 교합면 부위의 우식증을 전색할 경우 우식병소 부위의 세균 수를 증식하지 못할 수준으로 감소시켜 우식을 예방할 수 있다[6]. 또한, 초기 치아우식증은 재석회화가 가능한 동적 구조이므로 미세누출과 더불어 수복물의 세균 활성 억제 및 세균 대사작용을 방해하는 항균물질인 클로로헥시딘, 필러, 불소, 테트라사이클린 등을 이용하여 세균의 생성과 성장을 억제하는 항균 활성화 방법을 제시하였다[10-12]. 그러나 이러한 화학물질들은 재료의 물성 저하를 야기하고, 치면착색과 항생제에 의한 내성 형성 등 부작용이 나타나 새로운 대체 물질을 모색하고 있다[13].
최근 항균물질로 연구가 선행되고 있는 세륨옥사이드나노입자(Cerium oxide nano particles; CNPs)는 금속산화물 나노입자로 바이오의학 분야에서 폭넓게 적용되는 물질이며, 환경에 따라 용이한 산화 환원 성질을 이용하여 첨가제, 연마제, 촉매제로 응용될 뿐 아니라 UV차단제나 형광증감제로 보급되는 항균 및 항산화 효과가 뛰어난 새로운 재료로 각광 받고 있는 물질이다[14-16].
CNPs는 생체의료 분야인 항암작용, 특정 표적 세포의 약물전달 응용, 조직재생에도 활용되며 특히 박테리아에 대해 뛰어난 항균효과가 있다. 이는 유리된 Ce3+와 Ce4+이온들의 전환이 가능하고 유리된 이온들은 표면적을 증가하는 작용을 하여 그람양성 세균뿐 아니라 그람음성 세균의 다양한 각종 세균에 대하여 항균효과가 있음이 밝혀졌다[17-20]. 이는 다양한 입자 크기와 형태를 가진 CNPs의 응집과 분산의 특성에 의해 세균의 대사에 필요한 초기 바이오필름 형성의 억제 작용과 직접적인 세포벽 손상을 초래하여 다양한 병원성 세균에 항균효과가 있음을 입증한 것이다[18].
이에 본 연구는 항균물질로 바이오의학 분야 활용으로 잠재성이 높은 CNPs 효과를 확인하기 위해 불소 성분이 방출되지 않으며 non- filler 형태의 상업용 치면열구전색재에 첨가하여 표면거칠기의 특성과 표면에 나타나는 Streptococcus mutans의 부착도를 평가하여 새로운 치면열구전색재의 항균성을 평가하고자 한다.
연구방법
1. 연구재료
본 연구에서 사용된 치면열구전색재는 불소 미방출 제품인 ConciseTM(3M ESPE, USA, Lot number N758202)을 이용하였고 세륨옥사이드나노입자(Cerium(IV) oxide, Sigma, st. Louis, MO, USA, Lot number MKCD7986, < 25 nm particles)를 첨가하였다. 광중합에 사용된 광조사기는 LED광조사기(Curing light. VALOTM, ultradent co.. USA)를 이용하였다.
2. 연구방법
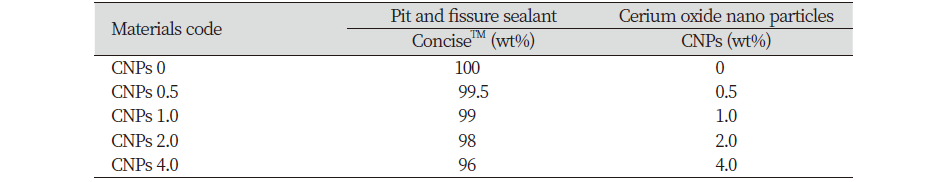
치면열구전색재(ConciseTM)에 CNPs를 무게비(wt%)로 계산하여 0, 0.5, 1.0, 2.0, 4.0%를 혼합한 후 초음파기를 이용하여 균일하게 분산하였다. 이때 빛과 발생하는 열을 방지하기 위하여 갈색병을 호일로 감싼 후 얼음을 넣어 분산하였다. CNPs를 첨가하지 않은 실험군을 대조군으로 사용하였다. 실험군과 대조군의 각 혼합비와 기호는 <Table 1>과 같다.
본 연구에 사용된 시편은 테프론 몰드로 제작된 디스크 형태의 φ 10 mm, 2 mm 내부에 CNPs를 첨가한 복합 치면열구전색재를 기포가 생기지 않도록 주입 후 앞. 뒷면 각각 40초씩 광중합하여 제작된 시편은 37℃ 100% 상대습도 항온수조에 1시간 보관 후 시편을 제거하였다. 시편은 각 실험군마다 5개씩 총 25개를 제작하였으며 제작된 시편은 SiC #400, 800, 1200 grit를 이용하여 연마한 후 세척하여 EO가스 멸균법을 사용하여 모든 시편을 멸균하였다(Person meidcal, Korea).
시편들의 표면거칠기 측정은 표준시편으로 조정된 표면조도형상측정기(SJ-400, Mitutoyo, Japan)을 이용하여 0.5 mm/s의 속도로 시편 중앙에서 4.0 mm 거리를 측정하였다. 실험군별 시편당 3회 측정하여 표면거칠기 파리미터 중 측정값이 영향이 적어 가장 안정된 결과값을 얻을 수 있는 Ra(㎛)값으로 평균을 측정하였다(n=5).
사용한 균주는 Streptococcus mutans(ATCC 25175)이며 멸균한 Brain Heart Infusion(BHI, Difco laboratories, Dickinson)배지에 5% CO2 37℃ incubator에서 배양하였으며, 멸균된 시편 위에 배양된 균주 1x 10^8 CFU/ml의 균주 100 ㎕를 5% CO2의 37℃ incubator에서 1시간 보관하였다. 시편을 PBS 용액으로 세척 후 12-well plate에 BHI 배양액을 넣은 후 균주의 활성화를 위해 incubator에서 3시간 배양한다. 프레스토블루(PrestoBlue®, Molecular Probes, USA)시약을 10% 희석하여 배양된 액체를 96 well-plate에 100 ㎕ 담아 흡광도 570 nm에서 600 nm에서 시간대별로 마이크로리더기를 이용하여 시편당 3회 반복 측정하였다(BioTek, Winooski, VT, USA). 24시간 후 LIVE/DEAD® BacLightTM Bacterial Viability kit (Invitrogen by Thermo Fisher Scientific, CA, USA)로 형광 염색한 후 Confocal Laser Scanning Microscopy(CLSM FV 300, OLYMPUS)로 시편 위에 부착된 사멸 균(dead bacteria) 붉은색을 관찰하였다.
3. 자료분석
통계분석은 PASW Statistics 20.0 (IBM SPSS Inc., Chicago, USA)을 이용하여 일원배치분산분석을(one-way ANOVA)하였으며 사후분석은 Tukey HSDa 다중비교 분석 p<0.05 유의수준에서 각 군의 통계 비교분석을 실시하였다.
연구결과
1. 표면거칠기(Surface roughness)
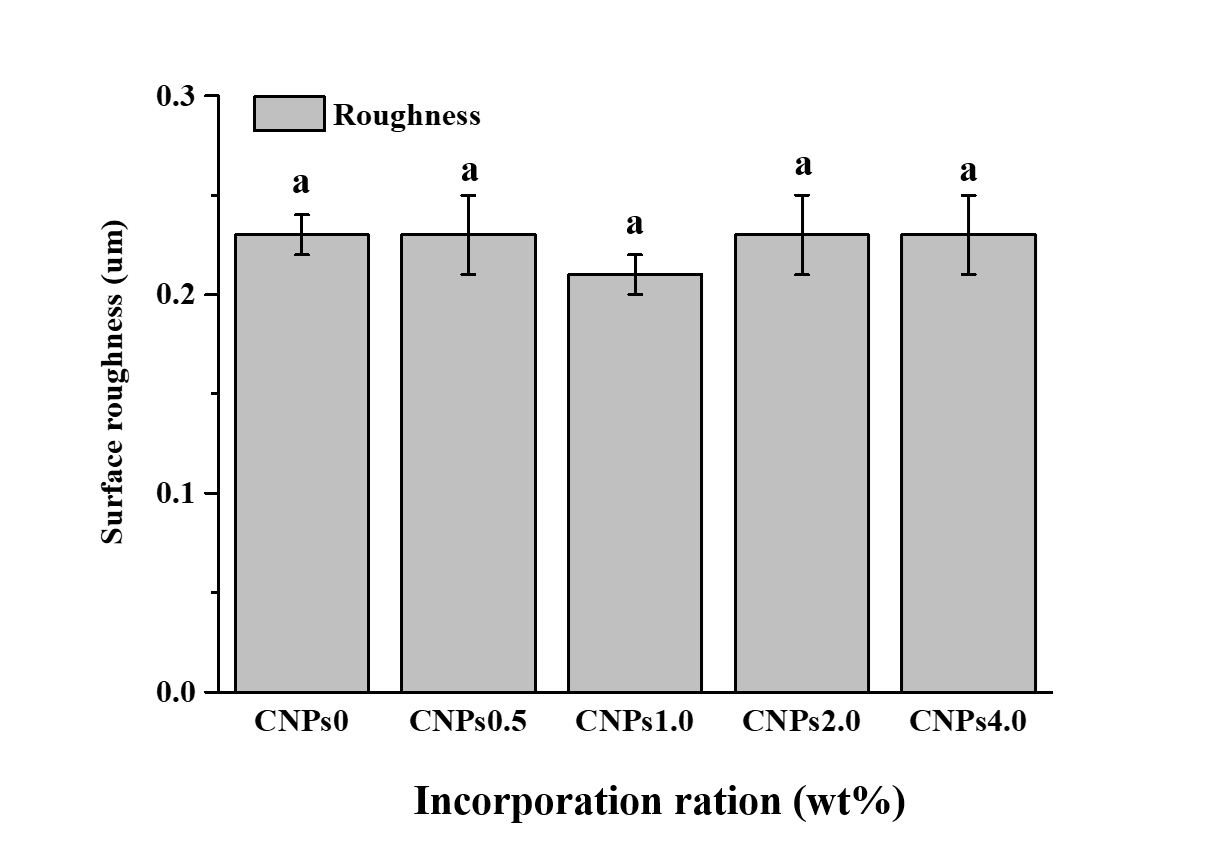
표면거칠기는 0.21 ㎛-0.23 ㎛ 범위를 나타냈으며 CNPs를 첨가한 실험군과 CNPs를 첨가하지 않은 대조군은 통계적으로 유의한 차이는 보이지 않았다(p>0.05)<Fig. 1>.
2. Streptococcus mutans 부착실험
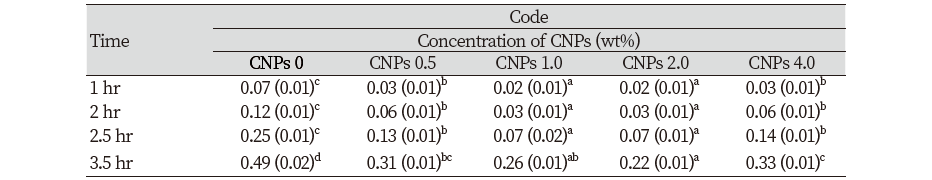
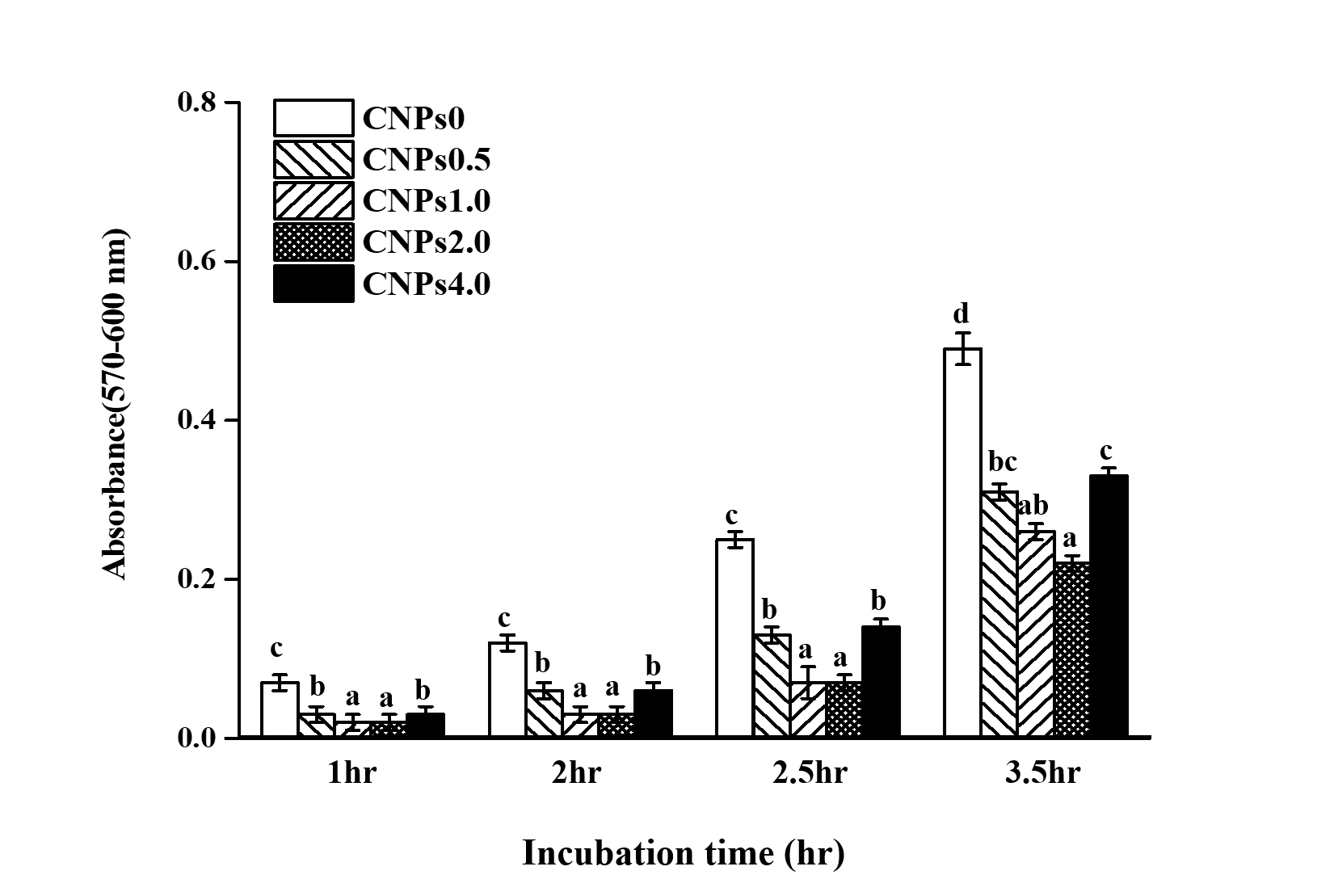
기존 치면열구전색재(ConciseTM)제품에 CNPs를 첨가하여 배양시간 경과에 따른 Streptococcus mutans 균 부착실험 결과는 <Table 2>와 <Fig. 2, Fig. 3>에 나타내었다. Streptococcus mutans균 CNPs 0 (0.07-0.49 nm), CNPs 0.5 (0.03-0.31 nm), CNPs 1.0 (0.02-0.26 nm), CNPs 2.0 (0.02-0.22 nm), CNPs 4.0 (0.03-0.33 nm)로 CNPs를 첨가하지 않은 CNPs 0에 비해 CNPs를 첨가한 모든 실험군에서 통계적 유의한 차이를 보였으며 특히 CNPs를 1.0 wt%와 2.0 wt% 첨가한 실험군에서 매우 낮은 값을 보여 뚜렷한 통계적 유의한 차이를 보였다(p<0.05)<Table 2><Fig. 2>.
Streptococcus mutans을 CLSM으로 붉은색으로 나타나는 사멸 균을 관찰한 결과 CNPs 0에서 관찰된 양이 가장 적었으며 CNPs 첨가한 실험군에서 사멸 균이 관찰되었으며 특히 CNPs 2.0실험군에서 가장 많은 사멸 균이 관찰되었다<Fig. 3>.
총괄 및 고안
구강 내 감염성 질환의 치아우식증은 다양한 구강 내 세균 중 S. mutans가 대표적인 주 원인균으로 구강의 경조직이나 연조직에 부착하여 바이오필름을 집락화 형성함으로써 경조직을 탈회시켜 질병을 유발한다[2,22]. 따라서 미생물의 부착을 억제하거나 바이오필름 형성을 방해하면 효과적으로 질병을 예방할 수 있다.
최근 나노입자기술의 활용은 환경, 산업, 의료 등 광범위한 분야에서 폭넓게 이용되고 있는 관심 물질로 1-100 nm범위의 다양한 크기, 모양, 표면적 비율에 따라 물리적, 화학적 성질이 다른 특징을 가지고 있다[22]. 이에 나노입자물질을 활용한 많은 선행연구에서 기계적 성질과 항균효과 있음을 입증하였다[3,23,24]. 특히 CNPs는 다양한 금속산화물 나노입자(ZnO, TiO2, FeO, CeO)중 바이오의학 영역에서 적용되는 나노입자로 주목받고 있다[18,23]. CNPs는 많은 선행연구에서 구강병의 예방과 수복을 목적으로 이용되고 있으며 바이오필름 형성에 영향을 주어 그람양성균과 그람음성균에 대해 항균작용이 있다고 보고되고 있다[18,23,25,26].
이에 본 연구는 항균효과가 입증된 CNPs를 상업용 치면열구전색재(ConciseTM)제품에 농도별로 첨가하여 새로운 치면열구전색재를 제조한 후 표면거칠기와 세균 부착실험을 통해 항균력을 평가하였다. 세균부착 기전에 영향을 미치는 요소는 표면의 특성과 밀접한 관련이 있으며 거친 표면은 세균부착에 필요한 표면적을 증가시키고 세균 군집을 탈락시키는 전단력에 대한 저항력을 증가시키는 작용을 한다[27]. 치면열구전색재의 표면거칠기는 0.21-0.23 ㎛로 실험군 간의 유의한 차이는 나타나지 않았다(p>0.05)<Fig. 1>. 이는 CNPs 입자가 균일하게 분산되어 표면거칠기에 차이가 없는 원인이라 여겨진다.
치아우식증의 대표 균주인 S. mutans는 치아 표면에 부착하여 바이오필름을 형성하고 초기 치아우식증을 유발하는 질환으로 부착 정도를 연구하여 항균효과를 평가하였다. CNPs 농도별 첨가에 따른 부착실험 결과 시간이 경과하면서 첨가하지 않은 CNPs 0 실험군에 비해 부착률이 감소하는 양상을 보였으며 CNPs 1.0과 CNPs 2.0 실험군에서 뚜렷하게 통계적으로 유의한 차이를 보였으나(p<0.05)<Fig. 2>, CNPs 4.0 실험군의 경우 CNPs 1.0과 CNPs 2.0 실험군에 비해 낮은 부착률을 나타냈다. 이는 농도에 의한 영향뿐만 아니라 세균부착은 재료 표면과 부착된 세균표면의 반데르발스 힘에 의한 물리적 결합에 의한 원자간 인력에 의해 형성되는 표면에너지의 영향으로 보여진다[28]. 그러므로 본 연구에서는 평가하지 않았으나 정확한 원인 규명을 위해서는 표면에너지와 세균부착의 연관성 연구가 필요할 것으로 여겨진다. CLSM 관찰결과 CNPs를 첨가한 실험군에서 첨가하지 않은 실험군에 비해 붉은색으로 보이는 사멸 균이 다량 관찰되었으며 특히 CNPs 2.0 실험군에서 가장 많이 관찰되었다<Fig. 3>. CNPs는 박테리아에 직, 간접적으로 세균에 흡착하여 세포벽이 손상되는 메커니즘에 의해 사멸된다고 보고하고 있다[18]. Arumugam 등[29]은 양전하를 가진 CNPs가 다양한 병원성세균의 세포 내부에 흡착하여 효소의 비활성화 작용으로 활성산소(Reactive oxygen species; ROS)를 생성하여 균을 사멸한다고 보고하였으며 Magdalane 등[30]은 CNPs의 나노입자가 바이오필름 형성을 억제하여 항균효과가 있다고 보고하였다. 위의 선행연구 결과 CNPs는 다양한 방법으로 균 사멸과 바이오필름에 영향을 주어 광범위한 분야에 응용할 수 있는 항균효과가 있음을 보여주고 있다. 그러나 Masadeh 등[31]은 그람양성과 그람음성 박테리아에 항균효과가 없다고 보고하였다. 이처럼 CNPs의 연구 결과가 다르게 보고되는 원인은 CNPs의 직, 간접적인 항균효과 기전이 환경에 따라 전환 가능한 산화적 특징으로 세포 표면에서의 Ce3+와 Ce4+이온 변화에 의한 특성에 의한 것이라 사료된다.
이상의 본 연구 결과로 CNPs를 치면열구전색재에 첨가 시 항균효과 증진이 가능하며 새로운 치면열구전색재 소재의 잠재성을 입증하였으나 실제 구강 내 환경에 존재하는 다양한 균주에 대한 평가가 이루어지지 못한 한계점이 있다. 향후 다양한 구강 내 균주에 대한 평가와 CNPs의 합성 방법, 표면특징, 크기, 농도, pH 등 소재의 다양한 추가적인 연구가 이루어져야 할 것으로 사료된다.
결론
본 연구는 기존의 치면열구전색재에 CNPs를 농도별로 첨가하여 치면열구전색재를 제조하고 표면거칠기와 세균부착을 평가함으로써 항균효과가 우수한 새로운 치면열구전색재를 개발하여 구강 양대 질환 중 하나인 치아우식증을 예방하는데 기여하고자 한다.
본 연구는 다음과 같은 결과를 얻었다.
1. 표면거칠기는 CNPs를 첨가한 실험군과 첨가하지 않은 실험군의 통계적 유의한 차이는 나타나지 않았다(p>0.05).
2. 세균부착량은 CNPs 0, CNPs 4.0, CNPs 0.5, CNPs 1.0, CNPs 2.0 순으로 유의하게 낮은 부착률을 보였다(p<0.05).
3. CLSM 관찰결과 CNPs를 첨가한 실험군에서 다량의 붉은색 사멸균이 관찰되었다.
CNPs를 활용하여 항균효과를 입증하였으나 향후 다양한 구강 세균에 대한 명확한 항균효과 메커니즘과 바이오의학 분야에서의 CNPs 응용에 대한 좀 더 깊은 연구가 필요할 것으로 사료된다.