서 론
치아우식증과 치주질환은 전 세계적인 구강질환으로 그 발병률이 점차 증가되고 있으며, 치균세균막의 세균에 의해 발생되어 치아손실까지 이르게 하는 주요 구강병이다[1,2]. 치아우식증은 치면세균막 내 세균에 의한 당질의 분해로 생성되는 산에 의해 치아의 법랑질이 손상되어 유발되는 질환이다[3,4]. 치주질환(풍치)는 치아를 유지해 주는 잇몸, 치주인대 등에서 일어나는 염증질환인 치은염과 치주염을 말하며, 치주조직을 파괴하는 질환이다. 치은염은 치주병균에 의해 발생되며, 잇몸질환의 초기단계로 잇몸이 부어오르는 현상이 관찰되고, 치주염은 치아와 주변조직의 만성염증성 질환을 말한다[5]. 구강질환의 원인으로는 많은 원인균주가 알려졌는데 치아우식증의 주요 원인균주로 Streptococcus sobrinus, Streptococcus mutans, Streptococcus sanguinis, Actinomyces viscosus 및 Actinomyces israelii 등이며, 타액순환이 느리고 Streptococcus가 높은 수치일 때 치아우식의 위험을 증가시킨다. 초기에 치아우식증을 유발하는 세균은 Streptococcus spp.이고, S. mutans는 집락형성 및 치주조직 침투, 치주조직을 파괴하여 치아우식증을 유발하며[6,7], S. sobrinus와 A. viscosus는 정상적 상주 미생물의 불균형을 초래한다[8].
치주질환의 발병과 관련된 세균으로는 Porphyromonas gingivalis, Aggregatibacter actinomy-cetemcomitans 및 Fusobacterium nucleatum 등의 그람 음성간균이 알려져 있다[9,10]. 구강질환의 예방 및 치료에 ampicillin, chlorhexidine, erythromycin, penicillin, tetracycline 및 vancomycin과 같은 항생제가 효과적이라고 보고되었으나[11], 장기간 사용 시 항생제의 내성과 인체에 대한 부작용 등의 문제점을 발생시킨다[12,13]. 특히 널리 사용되고 있는 chlorhexidine은 세균 수를 감소시키거나 치면세균막 형성을 억제하는 효과가 있으나, 지속적으로 사용할 경우 치아착색, 미각이상 및 구강점막의 작열감 등의 부작용을 유발한다고 보고된 바 있다[14-16]. 이처럼 구강환경 내에서 이상적인 항균제로는 구강 내 치아우식증의 원인 균주 및 치주염이나 구취 유발 세균에 대한 선택적 항균력이 우수하면서도 인체 및 환경 독성이 낮은 물질이 요구되므로, 부작용 없이 지속적으로 작용하면서 항생제를 대체할 수 있는 천연 항균물질에 대한 연구가 필수적이다[17-22]. 박 등[23]은 오배자 에탄올 추출물이 0.25 mg/ml 이상 농도에서 S. mutans 생성 억제 효과를 보인다고 보고하였으며, 또한 마늘, 고삼, 연잎 등 다양한 천연물질을 이용한 구강세균에 대한 항균효과 등이 보고된 바 있다[24-26].
이에 따라 본 연구에서는 주변에서 쉽게 구할 수 있는 식품재료인 버섯을 이용하여 치아우식증과 관련된 원인 균주에 대한 항균력을 증명하고자 한다. 약용버섯으로 많이 알려진 구름버섯은 운지버섯이라고도 하며, 담자균류의 민주름목 구멍장이 버섯과에 속하는 1년생 버섯으로 항암작용 및 항균효과가 있는 것으로 보고되었다[27-29]. 구름버섯은 균모가 얇고 단단한 가죽질에 반원형이고, 가을에 걸쳐 활엽수나 침엽수의 썩은 줄기나 가지에서 군생하며, 전 세계적으로 분포하므로 생육시기와 장소에 상관없이 쉽게 채취가 가능하여 민간요법 등에 이용되는 약용버섯이다[30]. 구름버섯의 알려진 성분으로는 수분, 단백질, 탄수화물, 섬유질, 회분, 지방질, 핵산, 아미노산, 다당류 및 스테로이드 등이 있다[31-34]. 구름버섯의 항암이나 항균활성에 대한 보고는 일부 있으나, 구강질환 원인균에 대한 체계적인 연구보고는 거의 없다. 따라서 본 연구에서는 구름버섯을 다양한 유기용매로 추출하여 치아우식증과 관련된 원인 균주에 대한 항균활성을 증명하고 구강용 항균소재로서의 사용 가능한 기초자료를 제시하고자 한다.
연구방법
1. 구름버섯 추출물 제조
구름 버섯은 전라남도 담양군에서 채취한 것을 구입하여 자연 건조시킨 후, 분쇄하여 사용하였다. 구름버섯 분말가루 50 g에 각 추출 용매 1 L를 가하여 상온에서 72시간동안 교반하여 추출하였으며, 추출액을 3번 감압여과(ADVANTEC No. 2, Advantec MFS, Inc., Tokyo, Japan)하여 진공회전증발기(rotary evaporator, EYELA A-1000S, Tokyo Rikakikai Co, Tokyo, Japan)로 농축시켰다. 추출용매로는 99.5% acetone, 99.5% ethanol 및 99% ethyl acetate (Daejung Chemicals & Metals, Siheung, Korea) 등을 사용하였으며, 농축된 각 추출물은 DMSO로 용해시켜 70 mg/ml의 농도로 일정하게 맞추어 4°C에서 보관하여 실험에 사용하였다.
2. 실험 균주 및 균 배양
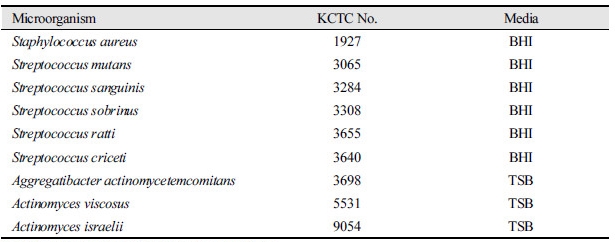
실험에 사용된 균주는 Staphylococcus aureus (KCTC 1927), Streptococcus mutans (KCTC 3065), Streptococcus sanguinis (KCTC 3284), Streptococcus sobrinus (KCTC 3308), Streptococcus ratti (KCTC 3655), Streptococcus criceti (KCTC 3640), Aggregatibacter actinomycetemcomitans (KCTC 3698), Actinomyces viscosus (KCTC 5531) 및 Actinomyces israelii (KCTC 9054) 등 구강균을 대표하는 9종의 균주로서, 미생물자원센터(Korean Collection for Type Cultures, KCTC)에서 분양 받아 사용하였다<Table 1>. S. mutans, S. aureus, S. sobrinus, S. ratti, S. sanguinis 및 S. criceti 등은 Brain-Heart Infusion (BHI, Difco, Detroit, MI, USA) 배지에, A. viscosus, A. israelii 및 A. actinomycetemcomitans 등은 Trypticase Soy Broth (TSB, BD Co., USA) 배지에 접종하여 24시간 동안 37°C 혐기성 배양기(5% CO2)에서 배양하였다.
|
Table 1. List of strains used for antibacterial experiments
|
|
|
BHI: Brain-Heart Infusion, TSB: Trypticase Soy Broth |
|
3. 추출물의 항균활성 측정
구름버섯 추출물의 항균활성 검색은 디스크 확산법(disc diffusion method)으로 측정하였다. 균배양액은 0.5 McFarland 표준 탁도(약 1.0×108 CFU/ml)로 맞추어 멸균한 면봉을 이용하여 미리 준비한 한천고체배지(agar plate)에 도말하였다. 도말된 배지에 각 추출물 30 µl (2.1 mg/disc)를 흡수 건조시킨 paper disc (ф 6 mm)를 밀착시킨 후, 37°C 혐기성 배양기에서 24시간 배양하였다. 배양 후, disc 주위에 생성된 억제환(inhibition zone) 생성 유무를 확인하고 그 크기를 vernier caliper (0~150 mm, color world, China)로 측정하였다. 3번 반복 실험하여 평균값으로 나타내었다. 양성대조군으로 100 µg/ml ampicillin을 사용하였다[35,36].
4. 미생물의 생육 저해율 측정 및 최소생육저해농도(MIC) 측정
9종의 구강세균에 대한 구름버섯 추출물의 최소생육저해농도(MIC)는 액체배지희석법(broth dilution method)으로 측정하였다. 각 구름버섯 추출액의 농도는 액체배지로 2배씩 희석하여 최종 10.50 mg/ml에서 0.04 mg/ml 농도가 되도록 조절하였다. 균배양액을 5×105 CFU/ml 최종농도로 맞춘 후, 96-well plate에 추출물 60 µl, 배지 40 µl 및 균 배양액 100 µl씩 주입하고 추출물을 첨가하여 37°C 혐기성 배양기에서 24시간 배양하였다. 600 nm에서 흡광도를 측정하여 균의 성장이 억제되어 균의 증식이 거의 나타나지 않거나 흡광도가 감소되는 최소농도를 MIC로 결정하였다.
5. 미생물 생육 저해곡선
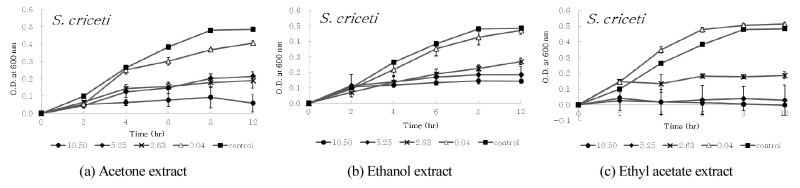
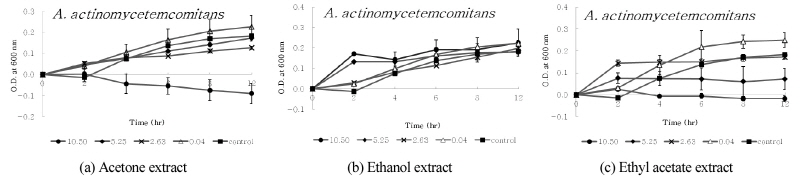
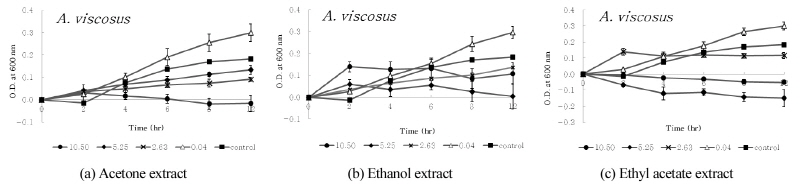
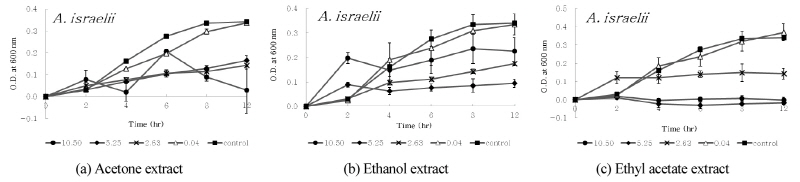
디스크 확산법에서 9종의 구강세균 중 구름버섯 추출물의 항균활성이 다소 높게 나타난 S. ratti, S. criceti, A. actinomycetemcomitans, A. viscosus 및 A. israelii 등의 균에 대한 구름버섯 추출물의 농도 및 시간 경과에 따른 생육저해효과를 조사하였다. 구름버섯 추출물의 MIC 값으로 나타난 10.50 mg/ml, 5.25 mg/ml, 2.63 mg/ml 및 0.04 mg/ml 농도의 구름버섯 추출물을 첨가하여 MIC 측정방법과 동일한 조건으로 실험하였으며, 37°C 혐기성 배양기에서 2, 4, 6, 8 및 12 시간 배양하면서 600 nm에서 흡광도(MECASYS, Korea)를 측정하였다. 추출물 대신 DMSO를 첨가한 용액을 음성대조군으로 사용하였다.
6. 통계처리
본 실험의 통계분석처리는 SPSS Statistics 23 (SPSS Inc., Chicago, IL, USA)을 이용하여 ANOVA test와 Duncan’s multiple range test로 α<0.05에서 그 유의성을 검증하였다. 모든 실험은 3회 반복 실험하였으며, 결과는 평균±표준편차로 나타내었다.
연구결과
1. 구름버섯 추출물의 항균활성
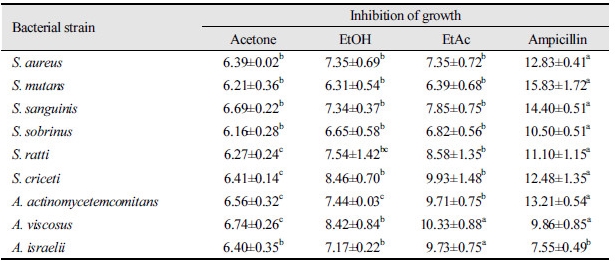
3종의 구름버섯 추출물(acetone, ethanol 및 ethyl acetate 추출물 등)의 9종 구강균에 대한 항균력을 조사하기 위해 디스크 확산법을 이용하여 생육저해환의 크기를 측정하였다. <Table 2>에 나타난 것과 같이, 3종의 용매 추출물 모두에서 9종 구강균에 대한 항균활성을 나타내었으며, acetone 추출물보다 ethanol 추출물과 ethyl acetate 추출물에서 더 높은 항균효과를 확인하였다. 이러한 항균효과는 S. aureus, S. mutans, S. sanguinis 및 S. sobrinus 등에서 추출 용매에 따라 유의한 차이를 보이지 않았다(p>0.05). 반면, S. ratti, S. criceti, A. actinomycetemcomitans, A. viscosus 및 A. israelii 등의 경우, acetone 추출물에 비해 ethanol 추출물과 ethyl acetate 추출물에서 유의한 차이를 나타내었다(p<0.05). 특히 A. viscosus에서는 ethyl acetate 추출물과 ampicillin의 생육저해환이 각각 10.33±0.88 mm, 9.86±0.85 mm 등으로 유의하게 높게 확인되었으며, A. israelii에 대해서는 ethyl acetate 추출물의 항균활성이 9.73±0.75 mm로 7.55±0.49 mm인 ampicillin보다 유의적으로 우수하게 확인되었다(p<0.05). 본 연구에서 얻어진 구름버섯의 구강세균에 대한 항균활성은 이전 연구에서 보고된 표고버섯 추출물의 A. actinomycetemcomitans와 A. viscosus에 대한 항균효과보다 더 높게 나타났다[37].
2. 구강미생물 최소생육저해농도(MIC) 측정
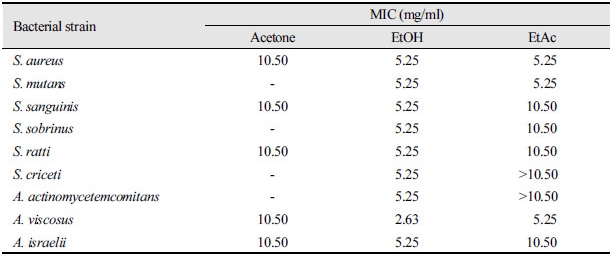
구강 미생물의 생육을 저해하는데 필요한 최소농도인 MIC는 액체배지희석법을 통해 측정하였다. 구름버섯 추출물 10.50 mg/ml로부터 0.04 mg/ml까지 2배씩 연속적으로 희석하여 24시간 배양 후 흡광도 측정 결과, 균의 증식이 거의 나타나지 않거나 감소되는 최소농도를 MIC로 결정하였으며, 결과를 <Table 3>에 나타내었다. 구름버섯 acetone 추출물은 S. aureus, S. sanguinis, S. ratti, A. viscosus 및 A. israelii 균 등에 대하여 모두 10.50 mg/ml의 MIC를 나타내었다. Ethanol 추출물의 경우는 8종의 구강균에 대하여 acetone 추출물보다 낮은 5.25 mg/ml이었으며, A. viscosus에서는 2.63 mg/ml의 MIC를 나타내었다. Ethyl acetate 추출물의 경우, A. viscosus에 대해서는 5.25 mg/ml이었으며, S. criceti와 A. actinomycetemcomitans에 대해서는 10.50 mg/ml 보다 더 큰 농도로 MIC가 확인되었다. 그리고 나머지 균의 경우에서는 10.50 mg/ml로 조사되었다. 구름버섯 ethanol 추출물은 acetone추출물과 ethyl acetate 추출물보다 낮은 농도의 MIC 값을 보였으며, A. viscosus에 대해서 ethanol 추출물이 가장 낮은 농도의 MIC 값을 나타내었다. 디스크 확산법에서 ethyl acetate 추출물이 더 큰 생육저해환을 형성하였으나, ethanol 추출물이 더 낮은 농도의 MIC 값을 나타내었다.
|
Table 3. Minimum inhibitory concentration (MIC) of extracts from Coriolus versicolor against oral pathogens
|
|
|
-: ND. EtOH: ethanol, EtAc: ethyl acetate |
|
3. 구강미생물 생육 저해곡선
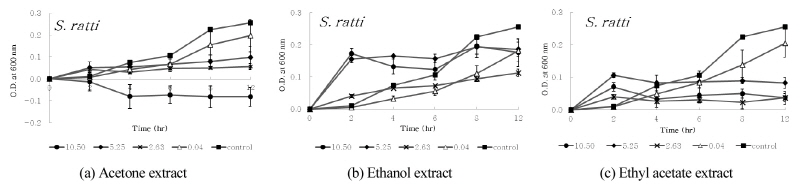
디스크 확산법에서 확인된 항균활성이 다소 높게 나타난 S. ratti, S. criceti, A. actinomycetem-comitans, A. viscosus 및 A. israelii 등의 균에 대한 구름버섯 추출물의 농도 및 시간 경과에 따른 생육저해효과를 조사하였다. 구름버섯 추출물의 MIC 값으로 조사된 10.50 mg/ml, 5.25 mg/ml, 2.63 mg/ml 및 0.04 mg/ml 농도의 구름버섯 추출물을 첨가하여 배양하였다. 2, 4, 6, 8 및 12 시간 이후, 흡광도를 각각 측정하고 추출물을 첨가하지 않은 대조군과 비교하였으며, 이를 <Figs. 1~5>에 나타내었다. 구름버섯 추출물을 첨가하지 않은 대조군에서는 6~8시간까지 균의 증식이 증가하고 그 이후 균의 생장이 다소 감소되었다. <Fig. 1>과 같이, S. ratti에 대해서 acetone 추출물은 약 4시간 이후 12시간까지 모든 농도에서 대조군과 비교하여 생육저해효과를 보였으며, 그 중 10.50 mg/ml에서 가장 강력한 항균효과를 나타내었다. Ethyl acetate 추출물은 0.04 mg/ml에서 2시간 이후 생육이 촉진되었으며, 2.63~10.50 mg/ml에서 시간 경과에 따라 생육 저해 효과가 증가되었다. Ethanol 추출물에서는 배양 초기에 5.25 mg/ml와 10.50 mg/ml에서 대조군에 비해 균의 생육이 촉진되었으나, 2시간 이후 생장곡선이 수평으로 유지되면서 정체기에 접어드는 것으로 확인되었다. <Fig. 2>와 같이, S. criceti에 대해서 acetone 추출물은 대조군과 비교하여 배양 초기부터 생육저해가 나타났으며, 2시간이후 농도가 낮은 0.04 mg/ml의 경우 균의 생육이 촉진되었고, 농도가 증가할수록 생육저해효과가 증가되었다. 또한 8시간 이후 10.50 mg/ml에서 증가된 생육저해효과를 확인하였다. Ethyl acetate 추출물의 경우에는 0.04 mg/ml에서 생육저해가 나타나지 않고 대조군보다 생육이 촉진되었으나, 농도가 증가할수록 acetone 추출물보다 생육저해 효과가 증가되었다. Ethanol 추출물의 경우에는 배양초기에는 농도에 따른 차이가 발생되지 않았으며, 2시간 이후에는 농도가 증가함에 따라 생육저해가 증가되어 12시간 후 10.50 mg/ml에서 71.1%의 생육저해효과가 나타났다. <Fig. 3>과 같이, A. actinomycetemcomitans에 대해서 acetone 추출물은 2시간 이후 10.50 mg/ml의 농도에서 강한 항균활성을 보였다. Ethyl acetate 추출물은 농도의 증가에 따라 일정한 생육저해율 차이를 나타냈으며, ethanol 추출물은 12시간까지 대조군에 비해 모든 농도에서 생육저해효과가 나타나지 않았다. <Fig. 4>와 같이, A. viscosus에 대해서 acetone 추출물은 0.04 mg/ml의 경우 대조군보다 균의 생육이 더욱 증가하였고 농도가 증가함에 따라 일정하게 생육저해율의 차이를 보였다. 10.50 mg/ml의 경우, 시간 경과에 따라 생육저해효과가 나타났으며, ethyl acetate 추출물은 5.25 mg/ml와 10.50 mg/ml 농도에서 배양초기부터 생육저해를 보이며 시간 경과에 따라 강한 항균활성을 보였다. Ethanol 추출물의 경우, 5.25 mg/ml 농도에서 균의 성장저해효과가 크게 나타났다. <Fig. 5>와 같이, A. israelii에 대해서 acetone 추출물은 10.50 mg/ml에서 6시간 이후, 시간경과에 따라 균의 성장 억제가 증가되었으며, ethyl acetate 추출물은 5.25 mg/ml와 10.50 mg/ml 농도에서 2시간 이후 균의 성장이 강하게 저해되는 것으로 나타났다. Ethanol 추출물의 경우 5.25 mg/ml에서 생육저해효과가 가장 컸으나, 다른 추출물에 비해 균의 성장이 다소 약하게 억제되는 것으로 확인되었다.
|
|
|
|
Fig. 1. Inhibitory effect of extract from Coriolus versicolor on growth of oral pathogen, S. ratti. The results represent the Mean±SD of values obtained from three independent experiments |
|
|
|
|
|
Fig. 2. Inhibitory effect of extract from Coriolus versicolor on growth of oral pathogen, S. criceti. The results represent the Mean±SD of values obtained from three independent experiments |
|
총괄 및 고안
일반적으로 식물은 alkaloid, flavonoid, terpenoid 및 tannin 등 다양한 2차 대사 물질을 포함하고 있으며, 이들은 항산화, 항염 및 항균 등의 효과가 알려져 있다. 표고버섯 추출물의 구강세균에 대한 항균활성 효과는 여러 보고가 있으며, 일부 버섯 추출물의 S. mutans에 대한 항균활성이 보고되었다[37-39]. 구강질환에 대해 항산화성 물질인 페놀 및 플라보노이드 화합물 등이 효과적이라는 것이 알려져 있으며, 추출 용매에 따라 용해되는 생리활성물질 및 그 함량이 다르므로 적절한 추출 용매를 선정하는 것이 중요하다고 보고되어 있다[40].
이에 본 연구는 9종의 치아우식증 및 치주질환 관련 균주를 대상으로 구름버섯의 acetone, ethanol 및 ethyl acetate 추출물에 대한 항균활성 및 균의 증식에 미치는 효과를 조사하였다. 사용된 균주는 치면세균막 형성에 중요한 원인균으로 알려진 S. mutans, 이 균주와 함께 치아우식 발생시키는 대표적인 균주인 S. sobrinus, 치아우식증에 직간접적으로 관여하는 S. aureus, S. sanguinis, S. criceti 및 S. ratti, 치주질환의 주된 원인균인 A. actinomycetemcomitans, 치주염을 유발하는 A. viscosus, 방선균증의 원인균인 A. israelii 등 9종이며, 이들 모든 균주에 대한 구름버섯의 항균활성을 조사하였다. 추출용매에 의한 항균효과를 살펴보면, 구름버섯의 acetone, ethanol 및 ethyl acetate 추출물은 9종의 구강균에 대해 항균활성을 모두 나타내었으며, S. ratti, S. criceti, A. actinomycetemcomitans, A. viscosus 및 A. israelii에 대해서 ethanol 추출물과 ethyl acetate 추출물이 acetone 추출물과 유의한 차이를 보이면서 항균활성이 존재하는 것을 확인하였다(p<0.05). 특히 ethyl acetate 추출물의 경우는 다른 추출물에 비해 상대적으로 상당히 강한 항균활성을 확인할 수 있었다. 본 연구에서 얻어진 구름버섯의 ethyl acetate 추출물은 S. mutans에는 낮은 항균활성을 나타내었으나, S. ratti, S. criceti, A. actinomycetemcomitans, A. viscosus 및 A. israelii 등에 대해서 박 등이 보고한 만가닥버섯의 ethyl acetate 추출물의 S. mutans에 대한 항균활성보다 더 높은 항균효과를 보여주었다. 또한 이미 보고된 표고버섯을 이용한 다양한 구강균에 대한 항균활성 연구에 따르면, 표고버섯 ethyl acetate 추출물에서 acetone 및 ethanol 추출물보다 더 높은 항균력이 확인되었다[39].
구름버섯 추출물의 항균활성이 상대적으로 다소 높은 S. ratti, S. criceti, A. actinomycetem-comitans, A. viscosus 및 A. israelii 등 5가지 균주에 대해서 구름버섯 추출물의 농도 및 배양시간에 따라 균의 성장에 미치는 효과를 살펴본 결과에 의하면, 2시간 이후 추출물의 농도에 따라 OD600 값이 다르게 나타났으며, 대부분 농도가 증가함에 따라서 대조군에 비해 균의 성장이 억제되었고, 2.63~10.50 mg/ml에서 대조군과 비교하여 50%이상 균의 증식을 저해하였다. 또한 실험 결과로부터 S. criceti에 대해 ethyl acetate 추출물, S. ratti에 대해 acetone 추출물, A. actinomycetemcomitans에 대해 acetone 및 ethyl acetate 추출물, A. israelii에 대해 ethyl acetate 추출물이나 A. viscosus에 대해 acetone, ethyl acetate 추출물 등은 높은 농도에서 2시간 이후 균의 성장이 발생되지 않고 감퇴시키는 것으로 조사되어 전체적으로 높은 생육저해효과를 확인하였다. 특히 A. viscosus에 대해서 ethyl acetate 추출물의 경우는 5.25 mg/ml 및 10.50 mg/ml 농도에서 배양 초기부터 균의 생육이 저해되는 효과를 나타내었다. Ethyl acetate 추출물의 항균활성이 다른 추출물에 비해 상대적으로 높게 나타난 디스크 확산법의 결과와 마찬가지로 MIC test나 생육저해실험 결과에서도 다소 높은 농도로 ethyl acetate 추출물이 첨가되었을 때 균의 성장이 크게 억제되는 것을 확인하였다. 구름버섯 추출물의 구강균에 대한 항균효과를 확인하였지만 MIC가 2.63~10.50 mg/ml의 비교적 높은 농도로 나타나 항생제 사용과 비교하여 연구의 제한점이라 할 수 있다. 그러나 구름버섯 추출물의 항균물질을 순수하게 분리하여 측정하면 더 낮은 농도에서 MIC가 얻어질 것으로 사료된다. 또한 A. actinomycetemcomitans와 A. viscosus에서 배양 초기부터 균의 증식이 발생되지 않고 균이 소멸되는 것으로 조사되어 결과적으로, 구름버섯 추출물은 치주질환 치료에 활용할 항균물질소재로서의 개발 가능성이 상당히 높을 것으로 생각된다.
본 연구에서는 구름버섯의 구강균에 대한 항균활성이 강하게 나타나는 용매를 선정하고 9가지 구강균주에 대한 증식 억제 효과를 확인하는 것을 목적으로 하였지만, 향후 구름버섯 추출물의 구강균에 대해 생장 억제효과를 나타내는 항균물질을 분리하여 이를 분석하는 기초연구 등이 수반되어야 할 것으로 생각된다.
결 론
본 연구는 구름버섯을 acetone, ethanol 및 ethyl acetate 등 3종의 용매로 추출하여 9종의 구강균주에 대한 항균활성을 조사하였으며, 생육저해곡선을 통해 균의 증식억제과정을 살펴본 결과는 다음과 같다.
1.디스크 확산법을 이용한 항균활성 결과, 9종의 구강균에 대해 모든 추출물에서 항균활성을 나타냈으며, 특히 ethanol 추출물과 ethyl acetate 추출물은 S. ratti, S. criceti, A. viscosus, A. israelii 및 A. actinomycetemcomitans 등에서 acetone 추출물에 비해 유의한 차이를 나타내었다(p<0.05).
2.구름버섯 추출물의 MIC는 acetone 추출물의 경우 10.50 mg/ml, ethanol 추출물은 5.25 mg/ml (A. viscosus에서 2.63 mg/ml), ethyl acetate 추출물은 10.50 mg/ml (S. criceti와 A. actinomy-cetemcomitans에 대해서 >10.50 mg/ml) 등으로 조사되었다.
3.9종의 구강균주 중 항균활성이 다소 강한 활성을 나타낸 S. ratti, S. criceti, A. viscosus, A. actinomycetemcomitans 및 A. israelii 등의 균에 대한 농도 증가 및 시간 경과에 따른 생육저해효과를 조사한 결과, acetone 추출물은 S. ratti, A. actinomycetemcomitans 및 A. viscosus에 대하여, ethyl acetate 추출물은 S. criceti, A. actinomycetemcomitans, A. viscosus 및 A. israelii에 대해서 강하게 균의 증식을 억제시키는 것을 알 수 있었으며, 또한 대부분 농도가 증가함에 따라서 생육저해 효과가 나타나는 것을 확인하였다.
이상의 결과에서처럼 구름버섯 추출물은 S. mutans, S. aureus, S. sanguinis, S. sobrinus, S. ratti, S. criceti, A. actinomycetemcomitans, A. viscosus 및 A. israelii 등에 대하여 항균효과가 있음을 확인함으로써 치아우식증 및 치주염 등의 구강질환에 효과적인 천연항균소재로서의 개발에 활용될 수 있을 것으로 사료된다.