서 론
치아는 크게 경조직인 법랑질과 상아질 그리고 연조직인 치수로 구성되어진다. 그 중 상아질은 치관뿐만 아니라 치근의 한 부분을 구성하는 석회화된 경조직으로 치아의 대부분을 차지한다[1]. 상아질은 치수세포에 의해 형성된 조직으로 형성시기에 따라 1차 상아질과 2차 상아질 그리고 3차 상아질로 나뉜다[2]. 1차 상아질은 치근이 형성되기 전, 2차 상아질은 치근이 형성 된 후 그리고 3차 상아질은 수복상아질로써 치아의 방어기전으로 형성된다[3]. 상아질 발생 과정은 치아의 형성 과정에서 외배엽성 간엽세포가 치아유두를 형성하고 상아모세포를 분화시켜 치관에 해당하는 상아질을 형성한다[4]. 치아의 아래 부위를 차지하는 치근은 치관이 완성되면서 발생이 되는데 Hertwig 상피근초가 치근을 따라 인접한 치유두세포로부터 상아모세포의 분화를 유도하여 치근 상아질을 형성한다[5]. 상아모세포로의 분화과정에서 전(구)상아모세포는 비아교질성 기질단백질인 I형 아교질과 알칼리성 인산분해효소(Alkaline phosphatase, ALP), osteonectin (ON), osteopontin (OP) 그리고 osteocalcin (OC)을 발현한다[6]. 특히 상아모세포는 세포막에 알칼리성 인산 분해 효소(ALP)가 존재하며, 이 효소는 세포의 외막과 석회화 조직에서 높은 분포도로 발견되는 것으로 알려져 있다[7]. 또한 석회화 과정 동안 무기인산을 전달, 석회화를 억제하는 역할을 하며 조골세포의 분화 유도 활성의 인자로도 널리 알려져 있다. 외부로부터 외상이나 치아우식증의 발생으로 상아질이 손상되었을 경우 형성되는 3차 상아질은 가까이 있는 치수를 보호하고 궁극적으로는 치아를 보호하는 역할을 하게 된다. 따라서 손상된 상아질을 재생하기 위해서는 상아모세포의 분화기전을 명확히 밝히는 것이 중요하다. 한약재는 전 아시아 지역에 예전부터 약용으로 많이 사용되어 왔으며, 최근 기능성 제품 개발로 인해 꾸준한 증가 추세에 있다. 이러한 측면에서 최근 한약재를 기반으로 둔 천연 물질에 대한 관심이 높아져 가고 있다. 그 중 승마(Cimicifuga rhizoma)는 우리나라에서 널리 분포할 뿐만 아니라 중국, 일본 등 아시아 지역 내에서 질병 치료에 사용되고 있는 한약재이다[8]. 승마는 미나리아재비과의 뿌리 줄기를 말하며, 전통적으로 갱년기를 치료하는 에스트로겐 호르몬 대체 요법으로 주로 쓰인다[9]. 그 뿐만 아니라 현재 항염증[10], 진통[11] 및 해열 치료[12]에 사용되며 구강내 혐기성균인 Porphyromonas gingivalis와 같은 구강 생물막의 세균에 대한 항균 효과[13]도 보고되고 있으며, 그 외에도 치석을 형성하는 칼슘에 대한 예방 효과[14]도 있는 것으로 알려져 있다. 그러나 승마추출물을 이용한 상아모세포의 분화효과에 대한 연구는 희박한 실정이다. 그러므로 본 연구에서는 승마 추출물을 상아모세포 전구세포인 MDPC-23 세포를 이용하여, 상아모세포의 분화과정 시 나타나는 ALP 발현정도를 확인하여 승마가 분화에 미치는 영향을 확인하고자 하였다.
연구방법
1. 세포배양
본 실험에 사용한 세포는 상아모세포인 MDPC-23으로 American Type Culture Collection (Rockville, MD, USA)에서 분양 받아 본 실험에 사용하였다. 세포를 배양한 조건은 다음의 <Table 1>과 같다.
2. 승마추출액 처리
본 실험에 사용된 승마는 국내산이며 (주) 화림 제약에서 구입하여 사용하였다. 승마는 추출에 용이하도록 하기위해 작은 크기로 파쇄한 다음 시료의 5배 정도에 해당되는 70% 에탄올 용매를 가하여 60°C에서 8시간 처리하여 상층액만 획득하였다. 여과지로 여과한 뒤 감압 농축기(Buchi, Meierseggstrasse, Flawil, Swizerland)로 50-55°C에서 농축하였다. 농축된 승마 추출물은 동결건조기(Ilshin Lab, Yangju-kun, Kyunggi-do, Korea)로 건조하여 Dimethyl sulfoxide (DMSO, Sigma-Aldrich, St. Louis, Missouri, USA)에 0.1 g/ml의 농도로 용해 시켰다. 배양된 MDPC-23 세포가 약 100%의 군집이 나타나면 용해된 승마 추출물을 골 형성 유도 배지(50 µg/ml L-ascorbic acid 2-phosphate, 10 nM dexamethasone 그리고 10 mM β-glycerophosphate과 10% fetal bovine serum (FBS)이 포함된 DMEM 배지에 희석하여 세포에 처리하였다. 그 후 24시간 동안 5% CO2배양기에 배양하였다.
3. 세포 성장률 측정
승마추출물이 세포 성장률에 미치는 효과를 정량화하기 위하여 WST-1 (water soluble tetrazolium salt-1) 분석 방법을 이용하였다[15]. MDPC-23세포를 96-well plate에 1×104으로 분주한 뒤 24시간 배양하였다. 24시간 배양한 후 세포의 상층 배지를 제거한 다음, 승마추출물을 각각의 농도로(0, 25, 50, 100, 150, 200 µg) 처리하였다. 승마 추출물이 처리된 세포를 24시간으로 배양한 다음 각각의 well에 WST-1 용액을 처리하였다. 2시간 동안 37°C, 5% CO2배양기에 반응시킨 후 ELISA reader (Multiskan FC, Thermo isher Scientific, Waltham, MA, USA)로 450 nm 파장에서 흡광도를 측정하였으며, 유의한 분석을 위해 독립적으로 세 번씩 시행하였다.
4. ALP 염색
100%의 세포군집이 나타난 상태에서 각각 농도의 승마추출물이 포함된 골 형성유도배지로 교체한 후 24시간 동안 분화시켰다. 24시간 후 배지를 제거하고 PBS로 2번 수세한 후, 3.7% 포름알데히드와 90% 에탄올로 2분간 고정하고 10분간 TBS (Tris Buffer saline) 용액에 세척하였다. 이후 5- bromo-4-chloro-3-indolyl phosphate와 nitroblue tetrazolium (BCIP/NBT, Amresco, Ohio, USA) 알칼리성 인산분해효소 기질로 10분간 염색한 후 사진 촬영을 실시하였다.
5. ALP 측정
100%의 세포군집이 나타난 상태에서 각각 농도의 승마추출물이 포함된 골 형성유도배지로 교체한 후 24시간 동안 분화시켰다. 24시간 후 배지를 제거하고 PBS로 수세한 후 0.5% Triton X-100을 첨가하여 용해시킨 후, 세포막을 파괴하고 상층액만 따로 채취하여 bradford법으로 595 nm에서 흡광도를 측정하여 동량의 단백질 양을 계산하였다. 각 실험군의 상층액 20 ㎕에 100 ㎕ p-NPP를 동일하게 첨가하여 37°C에서 15분간 반응시켰다. 0.2 M NaOH로 반응을 중단시킨 후 ELISA reader (Multiskan FC, Thermo isher Scientific, Waltham, MA, USA)로 405 nm에서 흡광도를 측정하고 효소 활성은 p-nitrophenol을 기준으로 정량화 하였다.
6. 통계 분석
세포성장률은 처리된 실험군의 결과를 통계 프로그램인 SPSS (Window 12.0)에 의해 일원분산분석(One-way ANOVA)을 이용하여 검정하였으며, 사후분석은 Tukey's 검정을 이용하였다.
연구결과
1. MDPC-23 세포에서 승마추출액이 증식에 미치는 영향
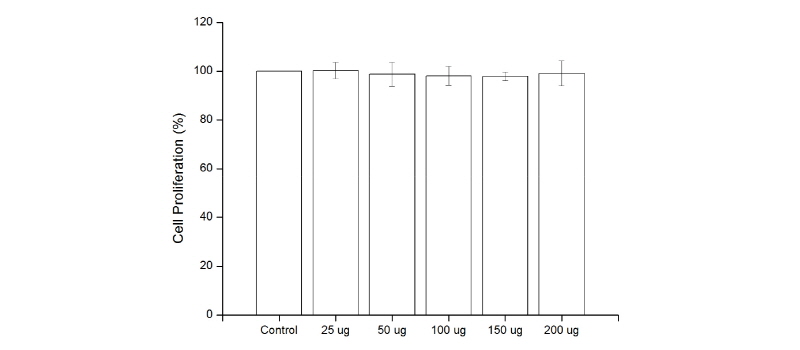
MDPC-23 세포에 승마추출물을 처리하여 세포 증식 및 증식에 미치는 영향을 WST-1 분석을 통해 관찰하였다<Fig. 1>. 대조군의 흡광도 값을 100%로 환산하여 분석한 결과 25-200 µg에서 각각 100±0, 100±3.29, 99±4.86, 98±3.80, 98±1.73, 99±5.05%의 결과를 보였다. 본 연구 결과, 대조군과 승마추출물 25-200 µg 농도로 처리한 경우 통계학적으로 유의한 차이가 없는 것으로 나타났다(p<0.794).
2. 승마추출물이 MDPC-23 세포의 ALP에 미치는 영향
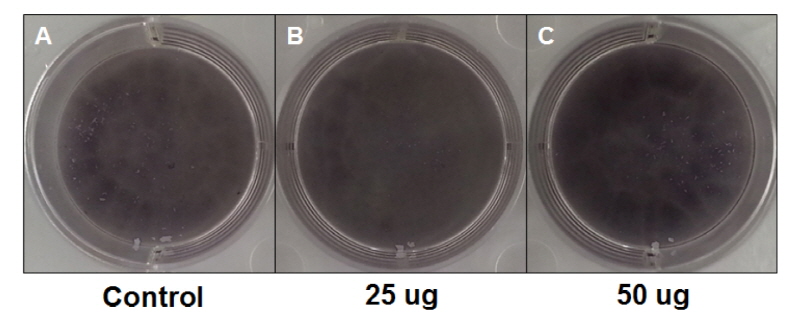
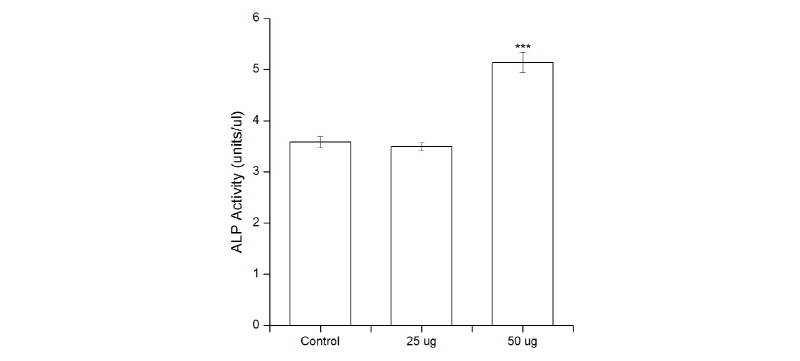
MDPC-23 세포의 활성에 미치는 영향을 알아보기 위해 상아모세포 활성의 지표효소로 널리 알려진 ALP를 측정하였다. 활성도의 영향을 확인하기 위해 염색 및 효소 측정을 실시하였으며, ALP 염색 실험 시 대조군보다 승마추출물을 적용시킨 경우 염색의 정도가 진하게 변화하는 것을 관찰하였다<Fig. 2>. 또한 승마추출물 25 µg 농도 보다 50 µg의 농도에서 더 진하게 변하는 것을 확인하였다. ALP의 정량화 실험 시 처리하지 않은 군은 3.6±0.11 units/㎕, 승마추출물 25 µg군은 3.5±0.08 units/㎕, 50 µg군은 5.1±0.20 units/㎕으로 나타났다. 대조군과 승마추출물을 25 µg 농도로 처리한 경우 차이는 없었으나(p<0.897), 대조군과 승마추출물을 50 µg농도로 처리한 경우 통계학적으로 유의한 차이가 있는 것(p<0.001)으로 나타났다<Fig. 3>.
총괄 및 고안
최근 재생 가능성이 있는 세포 또는 조직의 분화를 유도하여 원상태로 재생하려는 치료에 많은 관심이 집중되고 있는데 이러한 추세는, 법랑질을 제외한 주변조직들의 세포를 활성화시켜 상아질 형성 및 치수 조직을 재생하려는 연구에도 영향을 크게 미치고 있다. 치아는 일생에 유치와 영구치로 나뉘어서 맹출이 되며 다른 신체 손상과는 다르게 스스로 재생이 되지 않는다. 그렇기 때문에 최근 손상된 치아 기능을 회복하기 위한 치아 재생과 관련된 연구가 활발히 진행되고 있다[16-18]. 또한, 치아가 재생되기 위해서는 각 치아에 위치된 세포들의 분화를 유도하여 치아를 재생할 수 있는 능력을 가지는 것이 중요하다. 최근 이와 관련하여 상아모세포의 성장 및 분화에 대한 연구가 활발하게 진행되고 있다. 연구에 따르면 상아모세포에 저강도 저주파 초음파 적용 시 성장 및 분화 조절에 관여하며[1], 0.3 mmol/L의 과산화수소가 상아모세포에서 분화를 나타나는 지표인 ALP를 활성화시키는 것으로 알려져 있다[19,20]. 또한, 게나 새우에 존재하는 천연물질인 키틴을 탈아세틸화하여 제조하는 키토산도 상아모세포에서 분화를 유도하는 것으로 보고되고 있으며[21], 이는 상아모세포를 직접적으로 분화를 유도하여 치아 조직 재생에 효과적인 방법을 제시하고 있다. 따라서 본 연구는 상아모세포 전구세포인 MDPC-23 세포에 한약재로 알려진 승마추출물을 처리하여 그에 따른 효과와 분화 유도 특성을 분석하고자 하였다. 승마추출물이 MDPC-23 세포의 증식률에 미치는 영향을 확인하기 위하여 25 µg에서 200 µg 농도로 24 시간 처리 후 대조군과 비교 시 증식률에 차이가 없었다. 이는 승마추출물이 세포에 독성효과가 없으며, 이러한 결과는 승마추출물을 적절한 농도로 상아모세포 전구세포에 사용 시 세포의 분화에 효과적일 것으로 생각된다. 또한, 본 연구에서는 승마추출물이 세포의 증식률에 영향이 없는 최소 농도(25, 50 µg)를 설정하여 세포의 분화정도를 확인한 결과 상아모세포의 분화 지표인 ALP의 염색 결과에서 대조군보다 승마추출물이 처리된 군에서 염색의 정도가 진하게 변화되는 것을 관찰하였다. 이러한 변화는 ALP가 전상아모세포가 발현되는 초기 분화 표지자로 나타나며, 특히 골이 생성되는 과정이나 조골세포 분화과정에서 중요한 역할을 하는 것으로 알려진 것을 고려해볼 때 승마추출물이 ALP 발현에 영향을 미치는 것으로 생각된다. 이는 승마추출물이 처리되는 농도와 관련성이 있었으며 승마추출물 25 µg보다 50 µg에 처리 시 염색이 진하게 변화되는 것을 확인하였다. 수치상으로 확인이 되는 ALP의 정량화를 위한 실험에서도 염색 실험의 결과와 마찬가지로 대조군보다 50 µg의 농도가 처리된 군에서 유의하게 수치가 증가하는 것을 관찰할 수 있었다. 특히 승마추출물이 25 µg로 처리된 군 보다 50 µg의 처리된 군에서의 수치가 3.5 units/㎕에서 5.1 units/㎕로 증가된 것을 확인하였다. 이 결과는 치주인대섬유모세포의 분화유도 과정에서 처리 농도가 증가할수록 ALP 발현이 증가한다는 우 등[22]의 연구결과와 유사하다. 또한 케라틴 하이드로겔 성분이 MDPC-23의 세포를 분화시키는데 ALP의 활성이 증가한다는 사실과도 일치하는 결과를 보였다[23]. 또한, 김 등[24]의 연구에 따르면 승마추출물이 조골세포의 ALP 합성에 영향을 미치는 것으로 나타났다. 이러한 연구결과는 승마 추출물이 치주조직의 재생 및 분화에 효과적인 한방제재임을 보여주고 있다. 이에 본 연구 결과는 승마추물액에 의해 MDPC-23 세포의 분화를 유도하는 과정에서 ALP 발현에 영향을 미치는 것을 확인 할 수 있었으며, 이는 승마에서 추출된 물질이 상아모세포의 분화를 촉진시킬 수 있음을 제시한다. 그러나 본 연구는 분화와 관련된 ALP의 발현만을 관찰하였을 뿐 다른 분화 관련 인자에 대해서는 확인하지 못한 한계점을 가지고 있다. 이러한 한계점을 보완하여 후속연구에서는 상아모세포의 발현이 증가하는 ALP의 합성 기전과 상아모세포의 형성, 세포증식 및 분화를 촉진시키는 기전에 대한 추가 연구가 필요할 것으로 사료된다.
결 론
본 연구는 한약재인 승마추출물을 이용하여 상아모세포 전구세포인 MDPC-23 세포가 분화하는데 미치는 영향을 확인하고자 하였으며, 다음과 같은 결론을 얻었다.
1.승마추출물 25, 50, 100, 150, 200 µg 농도로 24 시간 처리 시 MDPC-23 세포 증식률 확인 결과 독성효과가 없는 것으로 나타났다.
2.분화의 정도를 알아보기 위한 ALP 염색 실험 시 처리하지 않은 군보다 처리된 군에서 염색의 정도가 진하게 변화하는 것을 관찰하였다. 또한 승마추출물 25 µg 농도 보다 50 µg의 농도에서 더 진하게 변하는 것을 확인하였다.
3.ALP의 정량화를 위한 실험에서 염색 실험의 결과와 마찬가지로 처리하지 않은 군보다 처리된 군에서 수치가 증가하는 것을 관찰하였다. 또한 승마추출물 25 µg 농도 보다 50 µg의 농도가 3.5 units/㎕에서 5.1 units/㎕로 증가된 것을 확인 하였다.
본 연구는 MDPC-23 세포에 승마 추출물 처리 시 세포독성은 관찰할 수 없었으며, 승마추출물이 50 µg의 농도에서 ALP 발현에 영향을 미치는 것을 확인하였다. 본 연구는 승마추출물을 이용한 상아모세포 분화연구에 기초자료로서 제시할 수 있으며, 차후 승마 추출물을 이용한 상아모세포 분화 연구 분야에 응용할 수 있을 것으로 사료된다.