서 론
우리나라는 고령화 사회에 들어감에 따라 노인들의 구강건강 삶의 질이 중요시 되고 있다[1]. 2010년 구강건강실태조사[2]에 따르면 우리나라 만 65세 이상 노인에서 적어도 한 악궁 이상 가철성 의치가 필요한 사람은 국소의치가 21.4%, 총의치 5.0%, 국소의치 또는 총의치는 24.8%였다. 더욱이 정부에서는 2013년도부터 75세 이상 환자에 대해 완전틀니 급여화 사업을 시행하고 있으며, 이에 따라 의치사용자인 노인인구는 더욱 증가될 추세이다[3].
의치는 자연치아와 같이 치면세균막 및 치석이 침착될 수 있으며, 청결하지 못한 의치는 심미적으로 악영향을 끼질 뿐 아니라 구내염을 유발할 수 있으며, 고령자에게는 전신질환을 일으킬 수 있다[4]. 초기 치면세균막에서 주로 관찰되는 세균은 Streptococcus mutans (S. mutans) 으로, 치면세균막 형성에 영향을 미친다. 또한 잔존하는 노인의 치경부 우식증과 S. mutans 과는 강한 상관관계가 있다[5]. S. mutans는 당대사 과정에서 유기산을 생성시키고 산성 환경을 조성함에 따라 의치성 구내염의 원인 균인 Candida albicans가 부착하는 것을 더욱 촉진한다. 따라서 의치를 사용하는 사람은 잔존하는 치아는 물론 의치의 S. mutans 등을 관리하여 건강한 구강상태를 유지하도록 해야 한다[5,6].
의치를 세정하는 방법으로 기계적, 화학적 방법이 있다. 기계적인 방법으로는 칫솔 등을 이용하여 세척하는 방법으로 의치에 칫솔질을 제대로 할 수 없는 노약자와 심신장애자들에게서는 올바른 방법이 시행될 수 없으며, 잘못된 칫솔질은 의치 표면에 흠집을 만들고 거칠게 해 음식물 잔사와 치석의 축척을 더욱 많이 발생시킬 수 있다. 화학적 방법은 의치세정액에 담구어 세척하는 방법으로 희석된 차아염소산나트륨 또는 과산화수소에 담가 세척할 경우 의치상의 표면을 변화시키기거나 맛과 냄새가 좋지 않다는 단점이 있다[4,7]. 따라서 최근 천연재료를 이용한 의치세정제에 대한 연구가 증가되고 있다[8-10].
일반적으로 식물에서 추출한 재료들이 천연 항미생물제로 사용되고 있으며, 그 중 티트리(Melaleuca alternifolia)는 terpinene-4-oi이 항미생물제의 주성분으로 바이러스 ,박테리아, 진균 등에 효과적이다[11]. 이는 선행연구에서 이미 확인하였듯이[12] 티트리 오일의 주성분이 세균의 세포막을 유지하고 기능을 할 수 없도록 하기 때문이다. 선행연구에서 티트리가 함유된 의치세정제는 구내염의 원인균인 Candida albicans에 우수한 항진균력을 보인 바 있었다[13]. 또한 Groppo 등[14]과 Fine등[15]은 S. mutans에 대한 항균력을 보여 구강 양치액으로써의 효용성에 대하여서도 증명한 바 있었다.
따라서 본 연구의 목적은 선행 연구에 이어 티트리 성분이 함유된 항균제의 개발 가능성을 평가하고자 의치상용 레진에 코팅된 티트리의 치면세균막 형성에 관여하는 S. mutans에 대한 항균력을 평가하고자 하였다.
연구방법
1. 연구재료
티트리 성분이 함유된 향균제를 제작하기 위하여 티트리 오일(Nimi Tea Tree Oil; Nice Day, Seoul, Korea)을 30 vol%, 50 vol%로 3차 증류수에 희석하였으며 유화제로 tween 40 (Q-P1504; Sigma, St. Louis, MO, US)을 첨가한 것을 실험군으로 정하였다. 대조군으로는 생리식염수만 적용하였다.
항균성분을 확인하기 위하여 시편을 자가중합형 의치상용레진(Jet Denture Repair; Lang Dental, Wheeling, IL, USA)으로 두께 2 mm, 지름 12 mm 형태로 표면관찰용 시편을 60개, 접촉각측정용 시편 60개, 항균실험용 시편 30개 총 160개의 시편을 제작하였다<Table 1>.
2. 연구방법
1) 표면관찰
티트리 용액이 의치시편에 코팅된 양상을 관찰하기 위해 대조군의 시편을 생리식염수에 보관하였고, 실험군의 시편은 티트리 용액을 30 vol% 그룹과 50 vol% 그룹으로 나누어 24시간, 48시간 동안 보관한 후 주사전자현미경(SEM, Scanning electron microscope, S-800, Hitachi, Ltd., Tokyo, Japan)으로 500 배 배율로 표면을 관찰하였다.
2) 접촉각 측정
티트리 용액에 의해 코팅된 시편의 친수성 변화여부를 확인하고자 접촉각측정 하였다. 접촉각 측정기(Contact angle measuring device, Phoenix 300, SEO, Korea)를 이용하여 증류수 10 µL를 떨어뜨린 후 즉시 접촉각을 측정하였으며, 각 실험군별로 접촉각 변화를 확인하였다.
3) 세균배양
항균력 평가를 위해 한국생명공학연구원에서 S. mutans (ATCC 25175)를 구입하였다. 구입한 세균을 BHI (Brain Heart Infusion, Becton, Dickinson and Co., U.S.A) 배지에서 24시간 동안 활성화 시킨 후 세균수를 확인하기 위하여 BHI 배지에 10배씩 희석 시켜 S. mutans을 3×105/mL로 만들었다. 세균시험을 위해 각 실험군당 10개씩 시편을 EO가스에 멸균하였으며, BHI와 Bacto agar (Bacto agar Becton, Dickinson and Co., U.S.A)를 제조사의 지시사항대로 혼합하여 고체배지를 제작하였다.
4) 항균력 평가
티트리 용액의 항균효과를 확인하기 위하여 S. mutans균의 Colony Forming Unit (CFU)를 관찰하였다. 먼저 의치상용 레진으로 제작한 시편에 티트리용액(30 vol%, 50 vol%) 및 생리식염수에 24시간동안 보관하였다. 보관한 후 티트리가 코팅된 시편에 S. mutans을 시편당 3 × 105/mL 로 분주하였다. 세균전용인큐베이터(M-tech Incubator, M-TECH Co., Korea)에서 24시간동안 배양한 후 시편을 증류수에 세척한 후 초음파세척기(Ultrasonic Cleaner SH-2100, Saehan, Seoul, Korea)에 1분 동안 적용하여 부착되어있는 세균을 떨어뜨렸다[16]. 세균의 현탁액을 채취하여 고체배지에 배양한 후 CFU를 확인하였다.
5) 통계처리
실험결과는 IBM SPSS Statistics ver. 20.0 (IBM Co., Armonk, NY, USA)을 사용하여 분석하였으며, 접촉각 측정결과의 그룹별 유의성을 검증하기 위해 one-way ANOVA와 paired t-test로 통계 처리하였다. 모든 분석은 95% 신뢰수준에서 시행되었다.
연구결과
1. 주사전자현미경(SEM) 관찰
24시간동안 생리식염수에서 보관한 대조군의 표면은 매끄러운 반면, 실험군인 티트리 용액을 사용한 실험군의 경우 30%와 50%에서 시편 표면의 다공성 입자 등이 관찰되어 시편 위로 고르게 분포 되어 있는 양상이 관찰되었다<Fig. 1>.
2. 접촉각 측정
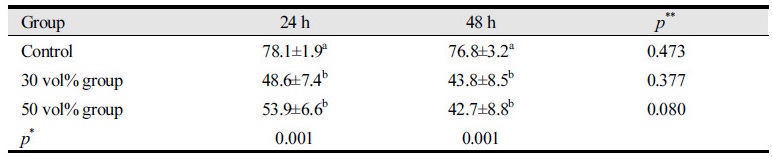
24시간 동안 시편을 보관한 경우 대조군인 생리식염수에서는 78.1°±1.9°, 30% 티트리 함유 용액에 보관한 그룹은 48.6°±7.4°, 그리고 50% 티트리 함유 용액에 보관한 그룹은 53.9°±6.6°이였다. 그리고 48시간 동안 시편을 보관한 경우 대조군인 saline에서는 76.8°±3.2°, 30% 티트리 함유 용액에 보관한 그룹은 43.8°±8.5°, 그리고 50% 티트리 함유 용액에 보관한 그룹은 42.7°±8.8°이였다. 24시간과 48시간 모두 대조군인 생리식염수 용액에서 보관한 시편의 접촉각이 유의하게 가장 높게 나타났으며(p<0.05), 이어서 50% 티트리 용액 보관 시편, 30% 티트리 용액 보관 시편 순으로 접촉각이 낮게 나타났다. 그러나 티트리 용액에서 보관한 시편 간에는 유의한 차이가 없었다(p>0.05). 그리고 24시간 동안 보관한 그룹과 48시간 보관한 그룹 간에는 접촉각의 유의한 차이를 보이지 않았다<Table 2>.
3. 항균실험
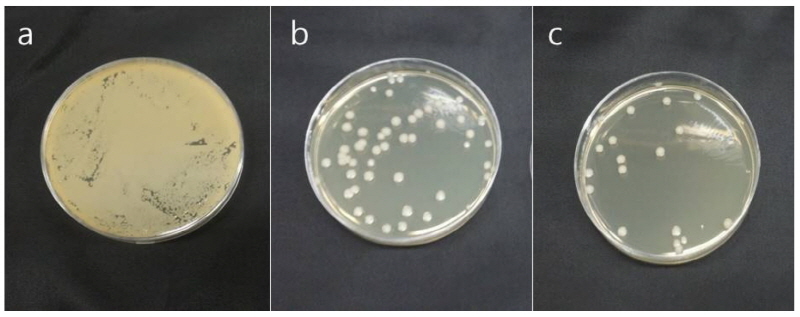
티트리 성분의 항균력을 확인하기 위하여 Colony Forming Unit (CFU)를 확인하였다<Fig. 2>.대조군 saline에서 보관한 시편은 5 × 104개로 나타나 실험군에 비하여 많은 세균수를 나타내었다. 그리고 티트리 30% 용액에서는 65±43개, 티트리 50%용액에서는 40±37개로 티트리 30%용액에서 보관한 군과 유의한 차이가 없었다(p>0.05).
총괄 및 고안
S.mutans는 구강내에서 흔히 찾아볼 수 있는 균 중에 하나로 Lactobacillus과 함께 치아우식증의 주 원인균이다. 이러한 구강 내 상주균은 연령, 신체적 물리적 조건, 개인의 구강 위생상태에 따라 비율과 종류가 달라진다. 특히 의치를 장착한 환자에게서는 일반 환자에서 확인되는 500여종의 균보다, 의치 표면에서는 많은 900여종의 세균들이 관찰되었다는 보고를 확인하였다[17]. 이러한 의치표면이나 구강 상피 등에 존재하는 S.mutans의 증식은 칸디다증의 주 원인균인 Candida albicans와의 활발한 증식을 야기한다[17]. 따라서 본 연구에서는 구강 내 상주세균인 S.mutans에 대한 티트리의 항균효과를 확인하고자 하였으며 상대적으로 구강 내 세균관리가 힘든 의치 장착자들을 대상으로 향후 연구에서 적용될 수 있는 의치세정제의 가능성을 확인하고자 하였다.
S.mutans의 항균성에 관한 연구는 많이 이루어지고 있지만 특히 항생제에 대한 내성을 가진 병원성 균의 증가로 인한 천연물질에 관한 연구에 관심이 증가되고 있다. 특히 황금, 후박, 고삼, 오미자추출물, 지의류 추출물등이 S.mutans에 항균력을 가지고 있는 것으로 확인되었다[18].
본 연구에서는 식물에서 추출한 천연 항 미생물제로 티트리를 적용하였다. 김[19]의 연구에서 티트리 오일은 실험에 적용된 합성방부제들보다 월등한 항균활성을 보인다는 보고가 있었다. 또한 가글 용액으로 티트리오일은 0.2%로 적용하였을때 구강 내 세균을 감소시키는 결과를 나타냈다고 하였다[14]. 본 연구에서 적용된 그람양성균인 S.mutans는 대조군인 saline용액과 달리 실험군인 티트리오일은 CFU (colony forming units)가 확연하게 감소하여 티트리용액은 그람양성균에서 확실한 효과를 보인다는 주장을 한 선행연구를 입증하였다[19].
구강항균제로 가장 많이 쓰이고 있는 클로르헥시딘은 치아착색, 불쾌한맛, 치은염증 반응 등 단점이 꼽히고 있다. 따라서 자연에서 추출한 천연물질을 여러 연구에서 시도하였다. 선행연구에서는 대나무 숯 분말에 대한 항균력 실험을 한 결과 대나무 숯의 농도가 높아질수록 S.mutans에 항균력을 보였다고 하였다[18]. 본 연구결과에서도 대조군과 실험군과 확연한 차이를 보였으며, 고농도의 티트리 용액 적용으로 인해 확실한 항균효과를 보인 것으로 확인된다. 저농도의 티트리용액으로도 항균효과가 있는지는 추후연구에서 확인해야 할 것으로 사료된다.
S.mutans의 경우 통성혐기성균으로 산소가 있는 환경과 산소가 없는 환경에서 생존할 수 있지만, 혐기성 환경에서 더욱 잘 자라는 것으로 확인되고 있다[3]. 본연구에서 확인된 티트리용액의 항균력의 이유를 확인하기 위하여, 티트리 용액이 적용된 시편의 접촉각을 측정하였다. 티트리 용액은 첨가되는 성분에 따라 친수성 또는 소수성으로 변화 할 수 있으며[20,21], 본 연구에서는 tween 40이라는 계면활성제를 사용하여 티트리 용액이 시편의 표면을 친수성성질로 변화시켰을 것 으로 사료된다. 따라서 티트리로 적용된 시편에서는 대조군과 비교하여 친수성 양상을 보였으며 이러한 결과는 S.mutans의 생존능력 저하시키고, 세균의 부착능력을 저하시킨 것으로 보인다. 하지만 24시간, 48시간 각각 실험군안에서 접촉각 유의차는 볼 수 없었다.
본 연구에서는 티트리 용액이 의치시편에 분포되어있는 양상을 확인하기 위하여, SEM으로 표면관찰을 한 결과 대조군과 달리 시편에 티트리 용액이 고르게 분포된 양상을 확인 할 수 있었다. 본 연구의 한계점으로는 저농도의 티트리 용액적용을 하지 못한 점과 다양한 세균에 대한 항균력을 평가하지 못하였으며 장기적인 항균력 평가를 하지 못하였다. 또한 티트리용액의 세포독성에 대한 비교실험을 수행하지 않은 점이다. 그럼에도 불구하고 본 연구에서는 이상의 연구 결과 티트리 용액은 S.mutans에 항균력을 나타냈으며, 추후 연구에는 티트리용액 적용 후 장기적인 향균력을 보이는지 확인하여야 할 것이며, S.mutans외에 다른 세균에 대한 항균능력과 재료의 표면 코팅 외에도 구강양치용액, 치약 등의 개발적용이 필요할 것으로 사료된다.
결 론
본 연구는 천연물질인 티트리 용액의 S.mutans의 항균효과를 확인하고자 하였다. 그 결과 다음과 같은 결론을 얻었다.
1.티트리 용액을 의치시편에 코팅한 결과 대조군과 달리 실험군은 티트리 용액이 시편위로 고르게 분포 되어있는 양상을 확인하였다.
2.티트리 용액으로 코팅된 시편의 접촉각을 측정한 결과 24시간 동안 시편을 보관한 경우 대조군인 생리식염수에서는 78.1°±1.9°, 30% 티트리 함유 용액에 보관한 그룹은 48.6°±7.4°, 그리고 50% 티트리 함유 용액에 보관한 그룹은 53.9°±6.6°으로 대조군 시편과 달리 실험군의 시편은 친수성을 나타냈다.
3.항균력을 확인하기 위하여 식염수에 보관한 대조군의 CFU는 5 × 104 CFU/mL으로 나타났으며, 티트리 30% 용액에 보관한 실험군에서는 65±43 CFU/mL, 티트리 50%용액에서 보관한 실험군는 40±37 CFU/mL로 가장 높은 항균력을 보였으나, 티트리 30%용액에서 보관한 군과 유의한 차이가 없었다(p>0.05).
이상의 연구 결과 티트리 용액은 S.mutans에 항균력을 나타냈으며, 추후 연구에는 티트리 적용후 장기적인 향균력을 보이는지 확인하여야 할것이며, S.mutans 외에 다른 세균에 대한 항균능력과 재료의 표면 코팅 외에도 구강양치용액, 치약 등의 개발적용이 필요할 것으로 사료된다.