서론
치과 임상 영역에서 사용되는 치아 수복, 보철재료는 법랑질, 상아질, 치수와 같은 치아 구조물 및 구강연조직과도 직접적으로 접촉하기 때문에 적합한 물리화학적, 기계적 및 생물학적 성질이 요구된다. 특히 치과 재료에는 치아 구조물에 자극을 미치는 성분이 포함되어 있기 때문에 치은과 같은 구강연조직 혹은 법랑질, 상아질, 치수와 같은 치아 구조물에 과도하게 축적되는 경우, 잠재적으로 술 후 과민증이나 독성을 유발할 수 있어 구강 내에 사용되는 치과재료는 각 재료의 생물학적 특성이 중요하게 고려되어야 한다.
현재 치과 영역에서 인레이, 온레이, 크라운과 같은 간접수복물 접착 시 흔히 사용되는 시멘트는 레진강화형 글래스 아이오노머 시멘트(Resin-modified Glass Ionomer Cement, RMGIC), 글래스 아이오노머 시멘트(Glass Ionomer Cement, GI), 폴리카복실레이트 시멘트(Polycarboxylate Cement, PCC), 인산아연 시멘트(Zinc Phosphate Cement, ZPC) 등이 있다. 이러한 치과용 시멘트는 각기 다른 재료학적 특성을 가지고 있어 사용자의 선호도에 따라서 사용되어 진다. 이 중 GI계 시멘트는 구강 내 적용이 되었을 경우 치질과의 화학적인 접착이 가능하고 불소를 유리시켜 항우식 효과를 가지고 있기 때문에 치과용 시멘트로 다양하게 사용되어져 왔다[1]. 하지만 GI계 시멘트는 복합 레진에 비해 압축강도가 낮은 물리적 특성을 가지고 있어 이를 보완하기 위해 레진 강화형 글래스아이오노머(RMGIC)가 개발되었다[2]. 실제로 RMGIC계의 간접수복재는 구강 내에서 용해되지 않고 물리적 강도가 높은 장점 때문에 치과 임상 영역에서 50% 이상 사용되어지고 있다[3].
RMGIC계 시멘트는 GI계 시멘트에 아크릴 레진(acylic resin)을 첨가한 재료이며 이 치과용 레진은 기질(matrix), 필러(filer), 결합제, 개시제 등으로 구성되어 있다[4-6]. 치과용 시멘트 기질 성분은 triethylene glycol dimethacrylate(TEGDMA), 2-hydroxy-ethyl methacrylate (HEMA), urethane dimethacrylate(UDMA), bisphenol A glycidyl dimethacrylate(BISGMA), bisphenol A 등과 같은 단량체들로 구성되어 있고, 이 단량체들은 수분이 많은 구강 내 환경에 장기간 노출될 경우 외부로 방출된다[7,8]. 이 중 기질의 주요 성분인 HEMA와 TEGDMA는 외부로 가장 많이 방출되는 물질로[9] 상아세관을 통해 지속적으로 치수세포에 노출될 경우 세포 사멸을 유도하며[10,11], 세포에서 활성산소의 생성을 증가시켜 세포 성장 억제 및 세포 사멸에 관여한다[12,13]. HEMA와 TEGDMA로 유발되는 산화 스트레스는 세포에서 유전 독성 효과를 보이고 세포주기 변형을 부분적으로 유발한다[5,6,14]. 특히, HEMA의 지속적인 노출은 접촉성 피부염과 같은 알러지 반응을 유발함과 동시에 흔한 알러지원으로 작용하여 다양한 종류의 생물학적인 반응을 야기한다[15,16]. 또한, 불완전한 중합에 의해 노출된 레진 단량체는 치수 세포에서 산화/환원 균형을 무너뜨려 산화적 손상을 유발하고 세포 내 미토콘드리아의 기능 이상을 일으킨다. 레진 단량체에 의한 세포 손상 과정에서 산화/환원 균형의 불균형은 과도한 활성산소종(reactive oxidative stress; ROS)을 생성하고 활성산소종 과다분비로 인해 세포 손상을 억제하는 글루타치온(glutathione; GSH)을 감소시켜 세포 사멸에 이르게 한다[12,17,18]. 이러한 과정에서 항산화제 중 하나인 N-acetyl-cysteine(NAC)의 처치는 치수세포에서 레진단량체로 유발되는 미토콘드리아의 형태학적 변화를 억제하고, 과생산된 활성산소종을 직접적으로 제거하거나 글루타치온의 전구체의 역할을 하여 감소된 글루타치온의 양을 보충하여 세포 사멸을 억제한다고 알려져 있다[19,20]. 이는 레진 단량체에 의한 세포사멸에 활성산소종이 중요하게 관여한다는 것을 시사한다. 하지만, 치과계에서는 레진 기반 재료와 관련한 활성산소종 조절에 관한 연구가 매우 부족한 실정이다.
대표적인 RMGIC계 간접수복용 시멘트 중 하나인 Nexus RMGIC는 우수한 사용 편의성, 강력한 치질 결합성 등으로 인해 치과 임상 영역에서 널리 사용된다. Nexus RMGIC는 HEMA, Ytterbium trifluoride(YbF3), 2-hydroxy-1,3-propanediyl bismethacrylate, (1-methylethylidene)bis[4,1-phenyleneoxy(2-hydroxy-3,1-propanediyl)] bismethacrylate로 구성되어 있으며, 이 중 HEMA의 구성 비율이 높게 차지한다. Nexus RMGIC에 대부분을 차지하고 있는 HEMA는 치주조직에 HEMA가 지속적으로 노출될 경우 세포의 기능이상을 초래하여 세포 사멸을 유발하기 때문에 Nexus RMGIC의 안정성은 세포생물학적 관점에서 평가가 필요하다.
이에 본 연구에서는 간접수복물 접착 시 사용되는 Nexus RMGIC의 세포생물학적 특성을 확인해보고자 치주줄기세포에 RMGIC계 시멘트를 적용하여 세포 사멸정도를 확인하고, 항산화제인 NAC을 통해 Nexus RMGIC에 의한 세포 사멸에 활성산소 생성이 기여하는지 확인하고자 한다.
연구방법
1. 연구 설계
본 연구는 레진 강화형 글래스아이오노머계 시멘트(RMGIC)의 세포 독성을 확인하고자 치주줄기세포에 Nexus RMGIC를 노출시켜 세포 생존율 변화와 활성산소종의 생성을 관찰하고자 하였다.
2. 연구재료 및 방법
1) 세포 배양
본 연구에 사용된 세포는 IRB 심의 제13조에 해당하여 00대학교 생명윤리위원회의 심의면제(1041493-E-2020-001)를 받은 치주줄기세포(PDSCs, periodontal stem cells)로서 교정치료 목적으로 발거한 제1소구치에서 치주인대 조직을 분리하였으며 Fluorescence-activated cell sorting(FACS) 분석법을 통해 치수유래 줄기세포의 특성을 확인한 세포주이다. 앞선 방법으로 추출한 치주줄기세포를 계대 배양하여 실험을 진행하였으며 10%의 fetal bovine serum(FBS, Gibco, Rockville, MD, USA)와 100 ㎍/ml penicillin/streptomycin(P/S, Gibco, Rockville, MD, USA)이 포함된 α-Minimum Essential Medium(α-MEM, Gibco, Rockville, MD, USA)으로 배양하였다. 치주줄기세포는 6well plate에 2×105, 96well plate에 1×104로 분주하여 24시간 동안 37℃, 5% 농도의 CO2 incubator(VS-9160C, Vision Scientific, Daejeon, Korea)에 배양하였다.
2) 약물처리 및 실험군 분류
치주줄기세포를 6well plate에 2×105로 분주하여 24시간 동안 배양한 후 세포가 60-80% 성장하였을 때 Nexus RMGIC(Kerr dental, Orange, CA, USA)를 처리하였다. Nexus RMGIC은 시편을 제작하여 적용하였으며, 약물처리를 위한 시편은 Ø5×2 mm의 teflon ring에 Nexus RMGIC(Kerr dental, Orange, CA, USA)를 채워 중합반응이 완전히 일어날 때까지 경화시킨 후, 1 mL의 serum free α-MEM배지에 24시간 동안 넣어 37℃에서 용출시켜 1:1 희석액을 만들었다[21]. 세포에 처리하기 위해 1:1 희석액을 0.2 ㎛ syringe filter를 이용하여 여과한 후, 2% 의 fetal bovine serum와 100 ㎍/ml penicillin/streptomycin을 포함한 α-MEM 배지를 첨가하여 2배 농도씩 늘린 희석액(1:1, 1:2, 1:4, 1:8)을 만들어 준비된 세포에 24시간 동안 넣어 배양하고 각 농도별 세포독성을 확인하였다. 항산화제인 N-acetyl-cysteine(NAC, Sigma, Saint Louis, MO, USA)은 멸균된 증류수에 녹인 후, 500 mM의 stock 용액을 만들어 사용하였으며 배지를 이용하여 10 mM NAC을 30분 전처리한 후, Nexus RMGIC 용출액을 농도별로 처리하여 세포사멸 정도 및 활성산소종 생성을 관찰하였다[22].
3) 세포 생존율 측정치주줄기세포를 96well plate의 각 well에 1×104 로 분주하여 24시간 동안 배양한 후 세포의 상층 배지를 제거하고, 준비한 Nexus RMGIC 시편의 용출액을(1:1-1:8) 각 농도별로 24시간 동안 처리하였다. NAC을 전처리한 그룹에서는 10 mM NAC을 30분 처리한 후 Nexus RMGIC 용출액을 농도별로 처리하였다. 처리 후, WST-1(EZ-cytox cell viability assay kit, Daeil Lab, Seoul, Korea) 10 ㎕씩 분주하여 1시간 동안 반응 시키고 ELISA reader(Multiskan FC, Thermo Fisher Scientific, Waltham, MA, USA)를 사용하여 450 nm 파장에서 흡광도를 측정하고 생존해 있는 세포수를 측정하였다.
4) 활성산소종 생성 확인
치주줄기세포를 6well plate에 2×105의 조건으로 분주하여 세포가 80% 성장하였을 때 Nexus RMGIC를 1:1-1:8 용출 희석액으로 처리한 후 생성된 활성산소종을 DCFDA/H2DCFDA-Cellular ROS Assay Kit(ab113851, Abcam, Cambridge, UK)를 이용하여 관찰하였다. NAC을 전처리한 그룹에서는 10 mM NAC을 30분 처리한 후 Nexus RMGIC 용출 희석액을 농도별로 반응시켰다. 반응 후, 제조사의 지시대로 세포의 상층액을 제거 후, Kit의 buffer로 1번 세척하고 20 µM 2', 7'-dichlorofluorescin diacetate를 45분 간 처리하고 나서 buffer로 2차 세척하였다. 세포 내 축적시킨 DCFH-DA는 Olympus IX71(Tokyo, Japan)를 이용하여 관찰하였으며 세포 내 활성산소종 발현 정도를 각 그룹별로 비교하였다. Image J 프로그램을 사용하여 염색된 세포의 형광을 수치화하였으며 세포 내에서 활성산소종을 증가시키는 tBHP(tert-Butyl hydroperoxide)를 양성대조군으로 사용하였다.
3. 자료분석
대조군과 실험군들의 통계 처리 결과는 통계 프로그램인 GraphPad Prism(GraphPad, CA, USA)을 통해 One-way analysis of variance (ANOVA) statistical method를 이용하였다. 사후검정으로는 Dunnett의 방법을 사용하였다. 평균과 표준편차는 3회 이상의 독립적인 실험의 결과를 통해 산출하였으며 p<0.05는 통계학적으로 유의성이 있는 것으로 판정하였다.
연구결과
1. Nexus RMGIC에 의한 치주줄기세포 사멸
치주줄기세포에 RMGIC계 간접수복재인 Nexus RMGIC를 농도별(1:1, 1:2, 1:4, 1:8)로 24시간 처리하여 세포 생존율에 미치는 영향을 WST-1 분석법으로 확인하였다. 치주줄기세포에 Nexus RMGIC의 농도별 처리 24시간 후, 일정한 방향성을 가지고 방추형으로 증식하는 대조군의 세포 형태와는 다르게 Nexus RMGIC의 농도가 증가함에 따라 치주줄기세포의 세포섬유(cell fiber)가 위축되는 것을 관찰하였으며 세포 수가 감소하는 것을 확인하였다<Fig. 1A>. Nexus RMGIC의 농도가 증가할수록 치주줄기세포의 생존율이 유의미하게 감소하는 양상을 보였으며, 특히 1:2, 1:1 Nexus RMGIC에서는 50-90% 이상 세포 사멸이 진행된 것을 확인하였다.
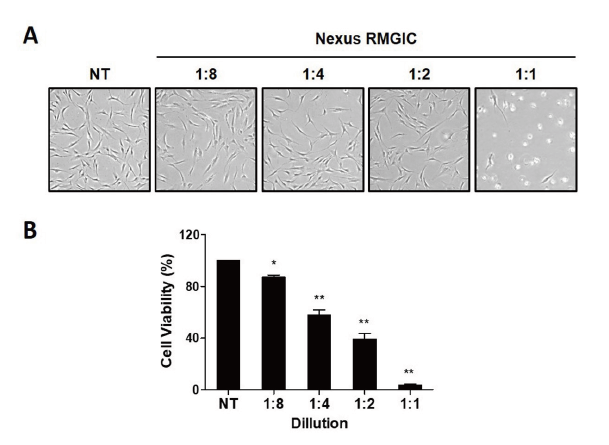
Fig. 1. The cell viability of PDSCs exposed Nexus RMGIC. PDSCs were exposed to different eluates of Nexus RMGIC (1:1-1:8) for 24 h. Representative images are shown in (A). (B) Cell viability of PDSCs exposed to Nexus RMGIC eluates analyzed by WST assay. Nexus RMGIC decreased cell viability of PDSCs in a dose-dependent manner. Data indicated as percentage relative to unexposed control group (100%). *p<0.05, **p<0.01 compared with control group (only medium).
2. 활성산소종 제거에 의한 Nexus RMGIC 세포 사멸 효과 억제
Nexus RMGIC에 의한 치주줄기세포의 세포 사멸에 활성산소종의 생성이 관여하는지 확인하고자 활성산소종의 제거제인 NAC을 전처치한 후 Nexus RMGIC를 투여하여 치주줄기세포의 형태학적 변화와 세포 생존율을 WST-1 분석법으로 확인하였다<Fig. 2>. 그림 A에서 보는 바와 같이 Nexus RMGIC의 농도별(1:8, 1:4, 1:2, 1:1) 세포 독성을 관찰한 결과, 농도가 증가할수록 치주줄기세포의 사멸이 유의미하게 증가하는 양상을 확인하였다. 특히, 1:2, 1:1의 Nexus RMGIC 용출 희석 배지를 치주줄기세포에 24시간 처리하였을 때에는 39, 3%의 세포사멸이 뚜렷하게 확인되었으며 세포의 형태적 변화 양상도 관찰되었다. 반면, <Fig. 2B>에서와 같이 10 mM NAC을 전처리한 그룹에서는 Nexus RMGIC 처리에 의한 세포 사멸과 세포 형태 변이가 억제됨을 확인하였다. 500 mM NAC stock을 배지를 이용하여 10 mM 농도로 희석하여 치주줄기세포에 30분 전처리한 후 Nexus RMGIC를 농도별(1:8, 1:4, 1:2, 1:1)로 처리하여 세포 독성을 관찰한 결과, 99%, 80%, 72%, 65%의 세포 생존율을 나타냄으로서 NAC에 의해 Nexus RMGIC로 유발되는 세포 독성 효과를 억제하였음을 확인하였다. 특히, 세포 사멸 양상이 뚜렷이 관찰되었던 1:4, 1:2, 1:1로 희석한 Nexus RMGIC에 의한 세포 독성이 현저하게 감소하는 것을 확인하였고 10 mM을 전처리하지 않는 그룹과 비교했을 때 치주줄기세포의 형태적 변화도 미미한 것으로 관찰되었다. 이와 같은 결과는 치주줄기세포에서 Nexus RMGIC에 의한 세포 사멸에 활성산소종이 중요한 역할을 한다는 것을 보여준다.
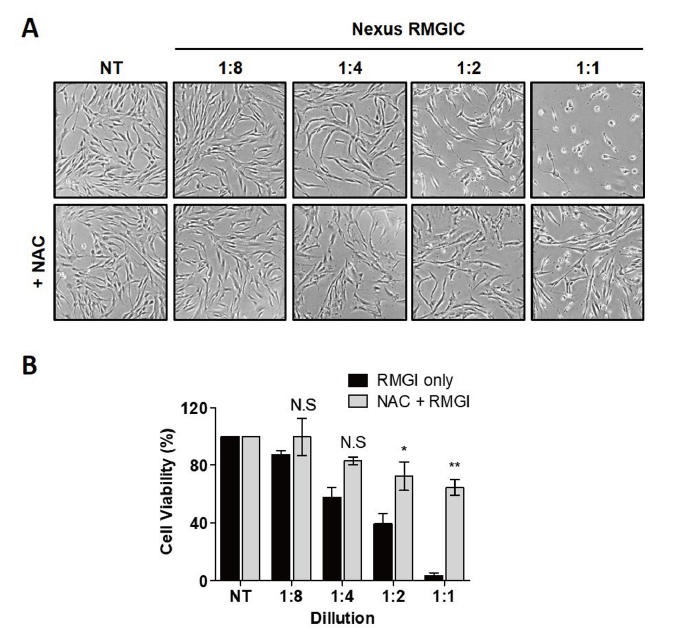
Fig. 2. ROS were involved in Nexus RMGIC-caused cytotoxicity in PDSCs. Representative images are shown in (A). (B) The cell survival rate of Nexus RMGIC in the presence or absence of 10 mM NAC was analyzed by WST assay. Data indicated as percentage relative to unexposed control group (100%). *p<0.05, **p<0.01; N.S: not significant
3. Nexus RMGIC에 의한 활성산소종 생성
치주줄기세포에서 Nexus RMGIC에 의해 활성산소종이 생성되는지 확인하기 위하여 활성산소종에 의해 형광을 내는 물질인 DCFH-DA로 형광염색을 한 후 형광현미경으로 확인하였다<Fig. 3>. 치주줄기세포를 Nexus RMGIC로 처치하거나 활성산소종의 제거제인 NAC을 전처치하고 Nexus RMGIC를 투여한 후 발현되는 활성산소종을 관찰하였다. Nexus RMGIC 희석액은 NAC에 의해 세포 생존율이 대조군과 유사하게 유지되는 농도인 1:4, 1:8을 사용하여 활성산소종 형성과 NAC 처리에 따른 활성산소종 억제 효과를 비교하고자 하였다. <Fig. 3A>에서 보는 바와 같이 1:4, 1:8 Nexus RMGIC를 24시간 동안 처치한 세포에서 세포 내 활성산소종이 증가한 것을 확인하였으며 농도가 높아짐에 따라 DCFH-DA에 의한 형광 발현이 증가하는 것을 확인하였다. 반면, 그림 3B와 같이 10 mM NAC을 전처리하고 1:4, 1:8 Nexus RMGIC를 투여한 치주줄기세포에서는 Nexus RMGIC만 처리한 세포에 비해 세포 내 생성된 활성산소종의 양이 현저하게 감소하였음을 확인하였다. 또한 발현되는 활성산소종의 양을 Image J 프로그램을 사용하여 형광 수치화한 결과 1:4, 1:8 Nexus RMGIC를 처리한 그룹에서는 21.28, 12.20임에 비해 NAC을 전처리한 1:4, 1:8 Nexus RMGIC 그룹에서는 8.33, 9.81로 나타나 항산화제인 NAC이 Nexus RMGIC로 유발되는 활성산소종 형성을 억제하는 것을 확인하였다.
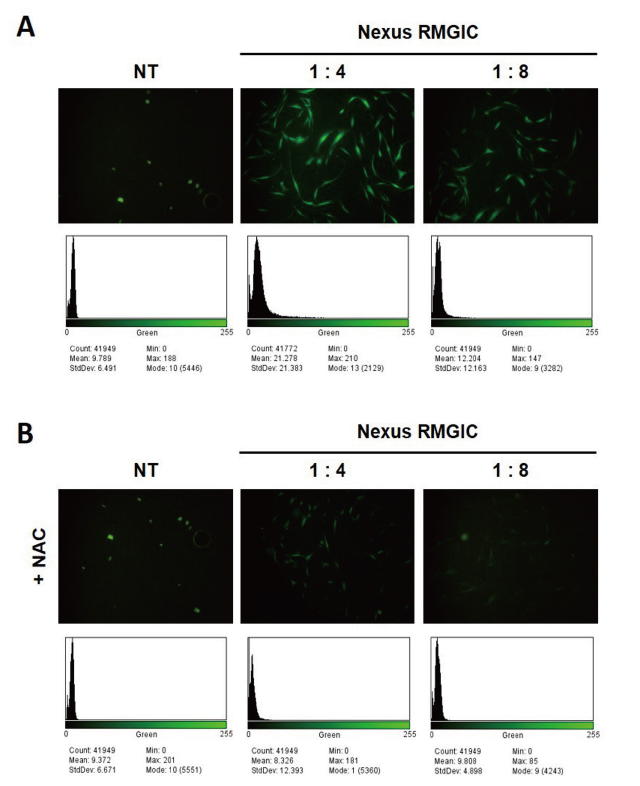
Fig. 3. Nexus RMGIC increased ROS generation in PDSCs. Representative images of fluorescence for DCF-DA (green), a ROS probe. The exposed cells to Nexus RMGIC (1:4, 1:8) alone (A) and Nexus RMGIC (1:4, 1:8) following 10 mM NAC showed different fluorescence intensity. The statistic number of fluorescence positive cells were counted using image J.
총괄 및 고안
치주질환은 구강질환 중에서도 전 연령대에서 관찰이 가능하며 50% 의 유병률을 가지고 있는 심각한 질환이다. 특히 치주질환 이환율은 청·장년층에서 꾸준히 증가하고 있으며[23], 이로 인한 조기 치아 상실은 저작 효율 감소, 영양 섭취 이상, 우울증 등의 문제를 초래하는 것으로 알려져 있다. 치주질환의 주원인은 세균성 염증 유발 성분인 lipopolysaccharide(LPS)와 산화 스트레스로 알려져 있다. 인간 치은 섬유모세포에서 LPS가 증가할 경우 활성산소가 증가하여 세포손상을 일으키며[24,25], 구강 내의 증가된 활성산소는 치주조직에 손상을 유발하여 치주염을 빠르게 진행시킨다[26].
활성산소종은 체내 대사과정에서 생성되는 부산물로 세포 내의 독성을 유발하고 암, 호흡기 질환, 신경퇴행성 질환, 소화기 질환과 같은 만성 및 퇴행성 질환의 발병과 관련이 있다[27]. 최근 연구에서 활성산소종은 세포 신호 전달을 조절하는 이차신호전달물질로 작용하는 것으로 알려져 있으며, 낮은 농도의 활성산소는 세포의 성장 및 사멸, 면역 등의 기능을 하지만 외부자극에 의한 다량의 활성산소종 생성은 세포 사멸을 유발한다[28,29]. 특히, 병리학적 원인에 의한 활성산소종 생성은 치주조직을 파괴하여 만성 치주염을 악화시킨다. 임상연구에서 항산화제를 처방한 치주질환자에게는 치은 지수 개선, 치주낭 깊이 감소, 임상적 부착소실의 억제와 같은 결과를 나타내고 있어[30] 치주조직의 손상을 예방하기 위해서는 구강 내 활성산소종의 과도한 생성을 억제해야 함을 시사한다. 그러나 치주조직 손상 방지를 위한 구강 내 활성산소 조절에 대한 연구는 부족한 실정이며, 구강 내 부적절한 항산화적 방어는 치주질환을 가속화시킬 수 있기 때문에 세포생물학적 수준에서의 활성산소 조절에 대한 접근이 필요하다.
최근 치과계에서 레진 합성물의 적용은 치과 임상 영역에서 수복용 시멘트, 심미수복물, 근관봉합제 등으로 다양하게 이루어지고 있지만, 레진 기반 합성물의 기질 성분은 치수세포에서 미토콘드리아의 형태학적 변화를 유발하고 산화적 스트레스를 증가시켜 세포 사멸을 일으키는 것으로 알려져 있다[20,31].
본 연구에서 사용한 Nexus RMGIC는 레진 강화형 글래스아이오노머 시멘트로서 구강 내에서 결합강도와 굽힘강도가 우수하여 간접수복물 접착재로 임상에서의 사용 빈도가 높지만 세포 손상을 유발하는 HEMA의 비율이 높은 치과재료이기 때문에 치수세포에 대한 안정성 평가가 필요할 것으로 생각된다. 따라서 본 연구에서는 Nexus RMGIC의 치주줄기세포에 대한 안정성을 평가하기 위해 농도별 Nexus RMGIC를 처리하여 세포 독성 효과를 확인하였다. 세포 생존율 실험에서 Nexus RMGIC 1:2, 1:1의 용출액을 처리한 실험군은 약물을 처리하지 않은 대조군에 비해 약 50% 이상의 세포사멸이 일어남을 관찰하였으며 특히, 1:1의 농도에서는 5%미만의 세포 생존율을 확인하였다. 이는 Bandarra 그룹의[14] RM-GIC의 세포 생존율과 유사한 수치이며, 1:1의 고농도의 세포 독성 차이는 시멘트 종류의 차이라 생각된다. 본 연구에서 Nexus RMGIC의 유출은 치주줄기세포에서 형태학적 변화 및 세포 수 감소를 유발하였으며, 이는 치수세포에서 레진단량체 노출에 의한 세포 수 감소 결과와 유사하고[20] HEMA 성분의 노출로 인한 세포 주기의 손상은 세포 성장을 억제한다는 연구 결과와 일치한다[6]. 또한, 레진단량체의 노출로 인한 치은 및 치수 섬유아세포의 세포 독성에 활성산소종이 관여하여 치수세포의 사멸을 초래하는 앞선 연구 결과[12,17,18]를 토대로 Nexus RMGIC로 인한 세포 사멸에 활성산소종이 관여하는지 확인하고자 하였다. 본 연구에서는 활성산소종 억제재인 NAC의 전처리가 Nexus RMGIC에 의한 치주줄기세포의 세포 사멸을 30% 이상 현저하게 억제한 것을 확인할 수 있었다. 특히, NAC의 전처리 후 Nexus RMGIC 1:4를 처리한 실험군에서는 대조군과 통계적으로 유의미한 차이가 없는 정도의 세포 사멸 억제 효과를 나타내었으며, 가장 고동노인 1:1에서도 65% 의 세포 생존율을 확인하였다. Jiao 그룹[20]에서는 레진단량체가 치수 세포에서 농도와 처리 시간에 따른 세포 사멸을 유발하고, NAC의 전처리가 레진단량체에 의한 세포 사멸을 억제한다고 보고하였다. 이는 Nexus RMGIC로 인한 세포 생존율 감소를 NAC이 억제하는 본 연구결과와 유사하다. 또한 Nexus RMGIC의 농도가 증가함에 따라 치주줄기세포 내 DCFH-DA의 형광 발현이 증가되는 것을 확인하여 Nexus RMGIC에 의한 활성산소종 생성을 관찰하였지만, NAC을 전처리한 경우 활성산소종 수준이 Nexus RMGIC에 의해 유발된 활성산소종의 수치보다 유의미하게 감소함을 확인하였다. 이는 Nexus RMGIC를 처리하지 않은 대조군의 수치와 차이가 없었고, 이러한 결과는 Nexus RMGIC가 활성산소종의 생성을 증가시키며 생성된 활성산소종이 치주줄기세포에 독성 효과를 일으키는 것을 의미한다. Schweikl 그룹[32]에서는 HEMA를 24시간 동안 세포에 노출시킨 후 활성산소종 생성 정도를 DCFH-DA로 측정하였고, 생성된 활성산소종은 활성산소종 억제재에 의해 현저하게 감소함을 확인하여 HEMA의 노출로 인한 세포 사멸에 산화적 균형 조절이 중요함을 보고하였다. 이는 본 연구에서 Nexus RMGIC에 의한 활성산소종 생성 증가로 DCFH-DA의 형광 발현이 증가하고, NAC 전처리에 의해 활성산소종 증가 및 DCFH-DA 형광 발현이 현저하게 억제되는 결과와 일치한다.
레진단량체는 치수세포에서 과도한 활성산소종 생성을 유발하여 DNA손상을 초래하고, 세포 사멸 기전에 관여하는 p53, Bcl-2, Bax를 조절하여 카스파아제-3(caspase-3)가 활성화됨에 따라 세포 사멸에 이르게 한다[20]. 특히, 치수세포에서 HEMA의 장기간 노출은 세포 사멸을 촉진하는 NF-KB 인산화를 촉진하고 세포 사멸을 억제하는 Trx-1의 발현량을 감소시킴으로서 세포 사멸을 일으키는 것으로 보고하였다[31]. 따라서 본 열구결과를 통해 Nexus RMGIC로 유발되는 세포 독성에 레진단량체인 HEMA로 유발되는 활성산소종 증가가 중요한 역할을 할 것이라 생각되지만, Nexus RMGIC에 의해 생성되는 활성산소종이 어떻게 세포 사멸을 유발하는지는 향후 연구를 통해 밝혀야 할 과제이다. Chen 그룹에서 관찰한 HEMA에 의한 세포 사멸은 5일에서 현저하게 관찰되었지만, 본 연구에서는 24시간 동안 용출된 Nexus RMGIC에 의한 세포 독성을 관찰하여 Nexus RMGIC 장기간 노출이 치주줄기세포에서 어떻게 작용을 할 것인지는 추후 연구가 필요할 것으로 생각된다.
현재 심미성과 사용용이성이 개선된 다양한 치과재료가 사용되고 있지만, 이에 관한 안정성 평가와 구강 내 발생할 수 있는 유해 기전에 대한 연구는 부족한 실정이다. 특히, 레진 복합물의 잔존단량체 등은 구강 내에서 타액에 의해 쉽게 이동되며 장기간 위치 시 실제 피부, 구강점막, 상아질, 치수, 골, 연조직으로 흡수되어 세포 독성 반응을 일으킬 수 있다. 또한, 유출된 기질 성분은 접촉성 피부염, 구강 내 작열감, 알러지 반응 등을 유발할 수 있어 영구접착재로 사용될 시 부정적인 임상결과로 이어질 수 있음을 시사한다. 따라서 본 연구를 통해 간접수복물 접착재로 사용되는 Nexus RMGIC의 유해성을 인식할 수 있어 실제 치과 임상에서 사용할 시 국소적인 부위에만 적용이 필요할 것으로 생각된다. 이와 더불어 치과 임상에서 사용되는 다양한 레진 복합체들의 안정성 평가를 위해 세포 독성 정도 및 그에 관한 세포 내 기전 연구가 더 필요할 것으로 사료된다.
결론
본 연구에서는 간접수복물물의 영구 접착에 사용되는 레진 강화형 글래스 아이오노머 시멘트 중 Nexus RMGIC가 치주줄기세포에 미치는 영향을 확인하기 위해 세포 생존율 변화를 확인하고, Nexus RMGIC에 의해 형성된 활성산소종이 세포 사멸에 관여하는지 확인하고자 하였으며, 다음과 같은 결과를 얻었다.
1. 치주줄기세포에 Nexus RMGIC의 용출액 희석액(1:1, 1:2, 1:4, 1:8)을 24시간 동안 처리하여 세포 생존율을 확인한 결과, 용출액의 농도가 증가함에 따라 세포생존율이 84%, 64%, 47%, 3%로 감소함을 확인하였다. 또한 농도 증가에 따른 세포 형태를 관찰해본 결과, 세포 섬유가 위축되며 세포 형태가 변형되어 세포 손상이 일어남을 확인하였다.
2. 치주줄기세포에 Nexus RMGIC를 투여했을 시 세포 사멸에 활성산소종이 중요한 역할을 하는지 확인하기 위해 활성산소종의 제거제인 NAC을 전처치하고 Nexus RMGIC를 처리하여 치주줄기세포의 형태학적 변화와 세포 생존율을 관찰하였다. 1:1-1:8의 Nexus RMGIC만을 처리한 그룹에서의 세포생존율은 87%, 58%, 39%, 3%이었으나 NAC을 전처리한 그룹에서는 99%, 80%, 72%, 65%로 나타나 NAC에 의해 Nexus RMGIC로 유발되는 세포 독성이 유의미하게 억제되는 것을 관찰하였다.
3. Nexus RMGIC에 의한 활성산소종(ROS) 생성을 DCFH-DA 형광염색으로 확인해본 결과 Nexus RMGIC 농도가 증가함에 따라 세포질 내에 많은 양의 활성산소가 발현되는 것을 관찰하였다. 이를 수치화한 결과 1:4, 1:8 Nexus RMGIC를 처리한 그룹에서는 각각 21.28, 12.20로 나타났다. 반면, 활성산소종 억제재인 NAC을 전처리한 그룹에서는 각각 8.33, 9.81로 나타나 Nexus RMGIC에 의해 발생하는 활성산소종의 생성이 억제되는 것을 관찰하였다.
따라서 본 연구의 결과를 바탕으로 Nexus RMGIC와 같은 레진 복합체 사용 시 기계적 평가 이외에도 세포 수준에서의 안정성 평가가 반드시 이루어져야 하며 레진 단량체에 의해 발생하는 활성산소종을 조절할 수 있는 임상 치료법의 개발이 이루어져야 할 것으로 생각된다.


