서론
구강 미생물총은 700 종 이상의 다양한 미생물 종에 의해 형성되며[1], 이 복잡한 생태계는 부적절한 구강 위생습관, 식이상태, 흡연, 스트레스 및 전신질환을 포함한 다양한 요인에 의해 변화될 수 있다[2]. 구강 내 미생물에 의해 치아우식증, 치주질환 등의 구강 감염질환을 유발하는 것으로 나타났고[3], 최근에는 심혈관 질환[4], 당뇨병[5]을 포함한 여러 종류의 전신질환과 구강 내 미생물의 연관성에 대한 보고가 증가하고 있다.
Probiotics는 “적절한 양으로 섭취될 때 인간의 건강에 유익한 영향력을 주는 살아있는 미생물(FAO/WHO 2001)”로 정의될 수 있고[6], 그 중 대표적으로 상용화된 Probiotics 종으로는 Lactobacillus와 Bifidobacterium이 있다[7]. 현재까지 연구된 Probiotics의 작용기전은 박테리오신을 비롯한 대사물질 및 영양 상호작용에 의한 구강 내 환경을 조절하여 병원균 부착 및 증식을 억제하고, 장점막의 방어벽 기능을 강화하여 병원균 미생물의 군락화 및 biofilm 형성을 저해하여 감염에 대한 저항력을 증가시키는 것이다[8]. 다수의 연구결과에서 크론병과 궤양성 대장염과 같은 장질환, 알레르기 및 결장암 등에 Probiotics가 유효함이 증명되었다[9,10]. Probiotics의 구강 작용에 대한 메커니즘은 명확하게 설명되어 있지 않지만, 위장관에서 작용하는 메커니즘과 유사한 방식으로 그 효능을 발휘할 것으로 보인다[11].
치과계에서도 Probiotics 효능에 관한 관심도가 증가되고 있으며, 특히 Lactobacillus 종들은 구강 생태계에서 중요한 역할을 담당하고 구강 질환 예방에 관련성이 있다고 보고되고 있다[12]. 구강에 대한 Probiotics 효능을 다룬 국내·외 연구에서 L. fermentum, L. salivarius, L. reuteri가 치아우식증과 치주염을 예방한다고 보고되었고[13-15], 그 중 L. reuteri는 reuterin이라 불리는 광역스펙트럼 항균물질을 생산하여[16] S. mutans, Candida albicans 등 구강병원성 세균인 그람 양성균과 그람 음성균의 증식을 억제한다[17]. 또한, L. reuteri 함유 정제를 섭취할 경우 타액 내 S. mutans (Streptococcus mutans)의 수준이 긍정적으로 감소한다고 보고되었다[15]. 이와 같이 L. reuteri 함유 Probiotics에 관한 선행연구는 S. mutans 증식 및 biofilm 형성과 관련하여 어떠한 영향을 주는지에 관한 연구는 미비한 실정이다. 또한, 치주질환에 관한 실험 연구에서는 대부분 매개변수(GI, PI, BOP, PPD, CAL 등) 측정에만 초점이 맞춰져 연구가 이루어져 왔다.
이에 본 연구에서는 L. reuteri를 함유한 Probiotics가 S. mutans와 A. actinomycetemcomitans (Aggregatibacter actinomycetemcomitans)에 대한 억제 효과에 미치는 영향을 평가하고자 한다. 또한, biofilm 형성, 초기 산도, 완충 능력 및 산 생성능을 측정하여 치아 우식 유발능을 확인하고자 하였다.
연구방법
1. 실험용액
실험에 사용된 용액은 L. reuteri 함유 Probiotics로 drop 형태 (Prodentis, BioGaia AB, Sweden, 2×108 CFU/ml)와 농후 발효유(Bulgaris, 남양유업, 한국, 1×108 CFU/ml)를 사용하였다. 이에 실험군 1은 L. reuteri 함유 Probiotics 처리군, 실험군 2는 농후 발효유 처리군, 대조군은 배양 배지 처리 군으로 나누어 실험을 진행하였다. 사용된 제품의 주요 구성성분은 <Table 1>에 각각 표시하였다. 대조군으로는 S. mutans 만을 배양하여 관찰한 배지로 사용된 BHI 액체배지(BactoTM brain heart infusion, Difco, USA)와 Columbia 액체배지(Columbia broth, MB cell, 한국)는 제조사의 권장사항에 따라 증류수와 혼합하여 교반하고, 121℃에서 15분간 고압증기 멸균을 시행하였다.
2. 구강미생물 배양
치아우식증과 관련된 우식 균주 S. mutans (KCTC 3065)는 한국생물자원센터에서 분양받아 37℃, 호기상태에서 BHI 액체배지에 배양 후 실험에 사용하였고, 생균수 측정을 위하여 BHI 고체배지(BactoTM brain heart infusion agar, Difco, USA)를 사용하였다. 또한, 치주질환 균주는 A. actinomycetemcomitans (KCTC 2581)를 37℃, 5% CO2 호기상태에서 Columbia 액체배지에 배양하여 활성화시킨 후 실험을 진행하였고, 5% Sheep blood (Sheep blood, 시너지이노베이션, 한국)를 첨가한 Columbia 고체배지(Columbia broth agar, MB cell, 한국)를 이용하였다.
3. 생균수 측정
S. mutans와 A. actinomycetemcomitans는 96 well plate에 농후 발효유와 L. reuteri Probiotics를 각각 0%, 2.5%, 5%, 10%가 되도록 BHI 액체배지로 희석하여 0.1 ml씩 분주하고 각각 균주를 0.1 ml (1×106 CFU/ml)을 접종하였다. S. mutans는 액체배지에서 24시간 배양 후 BHI 고체배지에 접종하여 37℃에서 24시간 배양된 생균수(CFU)를 측정하였고, A. actinomycetemcomitans는 액체배지에서 24시간 배양 후 5% Sheep blood를 첨가한 Columbia 고체배지에 접종하여 37℃에서 48시간 배양된 생균수(CFU)를 측정하였다.
4. Biofilm 형성 실험
S. mutans 생균수 측정을 위해 배양했던 96 well plate에서 배양액은 버리고 증류수 0.2 ml로 2회 세척한 다음 plate를 건조시켰다. 이후 0.1% Crystal violet 0.05 ml를 주입하여 15분간 실온에서 염색하고 증류수 0.2 ml로 2회 세척한 후 99% 에탄올 0.2 ml로 녹여서 흡광도 측정기기(Multiskan™ FC Microplate Photometer, Thermo Scientific™, USA)를 이용해 595 nm에서 흡광도를 측정하였다.
5. 초기 산도 및 완충능 검사
농후 발효유, L. reuteri Probiotics (증류수 1:1 혼합 용액) 각각 10 ml를 Falcon에 담아 초기 산도를 pH-meter (Cond 7110 meter, WTW inoLabⓇ, Germany)로 3회 측정 후 평균값을 구하였다. 완충능은 각 용액을 pH 7까지 변화시키는데 필요한 1M NaOH의 양으로 정의하며, 10 ml 용액에 1M NaOH를 첨가하여 혼합용액이 pH 7로 이르는데 때까지 주입된 NaOH의 부피를 측정하였다.
6. 산생성능 검사
농후 발효유, L. reuteri Probiotics 10% 용액에 1M NaOH를 첨가하여 혼합 용액이 pH 7이 되도록 중화한 후 5 ml씩 분주하여 S. mutans 균 0.5 ml (1×105 CFU/ml)을 첨가하였고 2초간 교반하였다. 이 용액을 37℃에서 8시간 배양하였으며, 2시간마다 꺼내어 변화된 pH를 pH-meter (Cond 7110 meter, WTW inoLabⓇ, Germany)로 3회 측정하여 평균값을 구하였다.
7. 통계분석
IBM SPSS (Statistical Package for Social Science 24.0, Chicago, IL, USA) 통계프로그램을 이용하여 분석하였고, 유의수준(α)은 0.05로 통계적 검정을 실시하였다. CFU 측정, biofilm 형성 결과는 대조군과 각 그룹의 농도별 차이는 one-way ANOVA를 시행하였으며, 두 실험군 간의 차이는 t-test를 실시하였다. 초기 산도 및 완충능 실험은 one-way ANOVA를 통해 Tukey 사후검정을 이용하였다. 또한, 시간에 따른 산생성능 실험결과는 two-way ANOVA를 시행하였으며 Scheffe로 사후검정하였다.
연구결과
1. S. mutans 생균수 측정결과
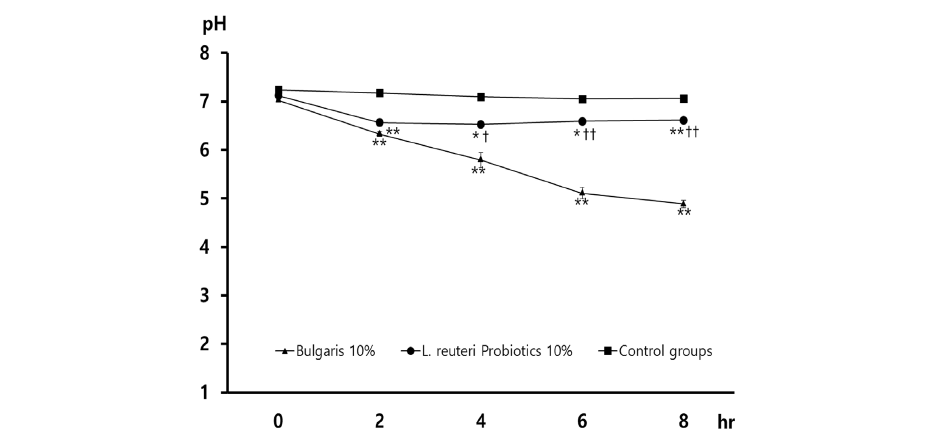
L. reuteri Probiotics, 농후 발효유, 대조군에 S. mutans를 동량 접종 후 생균수를 측정한 결과, 농후 발효유는 8×106 CFU/ml, L. reuteri Probiotics 318×106 CFU/ml, 대조군 342×106 CFU/ml로 측정되었다. 생균수 측정에서 대조군과 비교 시 농후 발효유에서 유의미한 S. mutans의 생장을 억제하는 양상이 관찰되었다. 반면, 대조군과 비교 시 L. reuteri Probiotics의 S. mutans 세균 억제 효과는 관찰되지 않았으며, 두 실험군 간 비교 시 농후 발효유가 L. reuteri Probiotics에 비해 유의미하게 S. mutans 세균 생장 억제 효과를 보임을 확인하였다(p<0.05)<Fig. 1>.
Fig. 1. (A) Comparison of viable cell count of S. mutans with all groups such as Bularis, L. reuteri Probiotics, and control. (B) Representative photograph for culture dishes for all group ① Bulgaris ② L. reuteri Probiotics ③ control (*p<0.05; Bulgaris vs control, †p<0.05: Bulgaris vs L. reuteri Probiotics)
2.A. actinomycetemcomitans 흡광도 측정결과
L. reuteri Probiotics, 농후 발효유의 농도별 A. actinomycetemcomitans 흡광도 측정결과, 농후 발효유의 경우 농도별 측정에서 농도가 높아질수록 높은 흡광도(optical density)를 나타내어 A. actinomycetemcomitans 생장이 유의미하게 증가하는 양상이 관찰되었다. 하지만 L. reuteri Probiotics의 흡광도는 농후 발효유의 흡광도보다 현저히 낮게 나타나, L. reuteri Probiotics에 의하여 A. actinomycetemcomitans 생장이 억제됨을 확인하였다(p<0.01)<Fig. 2>.
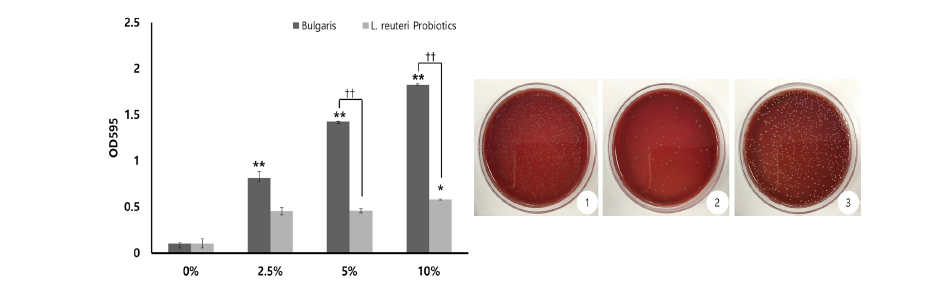
Fig. 2. (A) Absorbance on the number of viable cells of A. actinomycetemcomitans and all groups such as Bularis, L. reuteri Probiotics and control. (B) Representative photograph of culture dishes for all group ① Bulgaris ② L. reuteri Probiotics ③ control (*p<0.05, **p<0.01: 0% vs each % groups, ††p<0.01: Bulgaris vs L. reuteri Probiotics)
3. Biofilm 형성 실험 결과
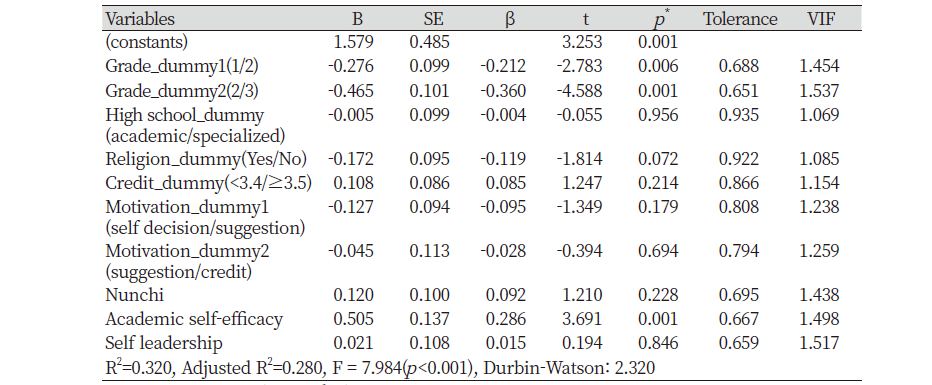
L. reuteri Probiotics, 농후 발효유에 S. mutans를 첨가한 후 biofilm 형성 정도를 비교 측정한 결과 <Fig. 3>, L. reuteri Probiotics, 농후 발효유 0%에서 높은 흡광도를 나타냈고, 0%와 비교하여 농도별 biofilm 감소량에 유의한 차이가 있었다(p<0.01). 2.5% 농도에서, L. reuteri Probiotics 및 농후 발효유의 흡광도는 유의한 차이가 있었다(p<0.01).
4. 초기 산도 및 완충능 검사
L. reuteri Probiotics, 농후 발효유, 대조군의 초기 산도 및 완충능 검사를 측정한 결과<Table 2>와 같았다. 초기 산도는 농후 발효유가 대조군에 비해 가장 낮았고(p<0.01), L. reuteri Probiotics도 대조군과 유의한 차이를 보였다(p<0.01). pH 7까지 이르는데 필요한 1M NaOH 양으로 정의하는 완충능은, 대조군 0 ml, L. reuteri Probiotics 0.07 ml, 농후 발효유가 0.73 ml로 높게 나타났으며, L. reuteri Probiotics와 농후 발효유의 유의한 차이를 보였다(p<0.05).
Table 2. Initial pH and buffering capacity of Bulgaris, L. reuteri Probiotics, and control groups
|
|
*p<0.05, **p<0.01: control vs group |
5. 산생성능 검사
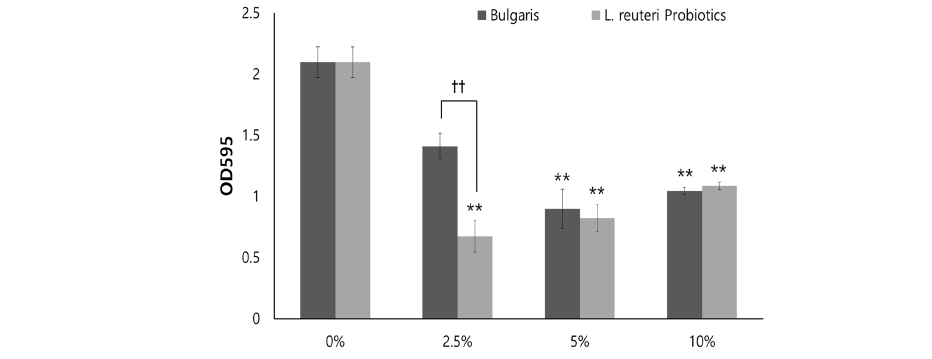
L. reuteri Probiotics, 농후 발효유 용액에 1M NaOH를 첨가하여 pH 7로 중화시킨 후 S. mutans와 혼합하여 2시간 간격으로 산도를 측정하였다. 6시간 경과 시 농후 발효유 실험군에서는 pH 5.5 이하로 감소였으며, 8시간 경과 후 L. reuteri Probiotics 10%는 pH 6.6, 대조군은 pH 7.0으로 유지되었다. S. mutans의 산생성능에 의한 pH 변화에는 집단 간의 유의한 차이가 있었다<Fig. 4>.
총괄 및 고안
Probiotics는 in vitro 또는 in vivo에서 병원성 세균의 성장을 억제하며[18] 이들의 중요한 기전은 면역증진, 병원성 미생물과의 장내 영양소를 경쟁적으로 이용, 장내 세포 또는 장점막에 병원성 미생물의 부착 억제, 장 상피세포에 침입 억제, 항균물질의 생산 등을 통한 장 건강을 증진한다고 보고되었다[11]. 구강 내 Probiotics의 이용은 적어도 병원성 세균들과 경쟁적으로 작용하여 구강 미생물과 면역반응에 영향을 미치는 것으로 보이며, 구강 건강 및 구강질환의 예방에 도움을 줄 수 있다[19]. 즉, 구강 내 병원성 세균의 성장억제는 치아우식증, 치주질환 등 구강질환뿐만 아니라 음식 섭취와 함께 소화기관으로 이동하여 당뇨병, 심혈관 질환 등 전신질환의 예방 및 치료에도 중요한 역할을 한다[18]. 이에 본 연구에서는 시판되는 L. reuteri 함유 Probiotics가 구강 미생물의 억제 및 biofilm 형성 억제 작용을 하는지 평가하고자 하였다.
본 연구결과 치아우식증을 일으키는 S. mutans 사멸 효과에서 농후 발효유가 L. reuteri Probiotics와 대조군에 비하여 높은 S. mutans 사멸 효과를 보였다. Nikawa 등[14]의 연구에서 S. mutans 1 : L. reuteri 3로 희석 시 S. mutans균이 90% 이상 사멸할 수 있다고 보고하여 본 연구결과와 차이를 보였다. 이는 L. reuteri Probiotics와 S. mutans 희석 비율이 낮은데서 기인하는 것으로 L. reuteri Probiotics가 S. mutans 억제 효과를 나타내기에 충분한 균수에 도달하지 못했을 것으로 생각되며, 사용한 특정 제품에 함유된 균수가 변수로 작용하였을 것으로 판단된다. Ishihara 등[13]은 L. reuteri와 표현형이 유사한 L. fermentum가 in vitro에서 S. mutans에 대한 성장억제 효과를 가지고 있음을 보고하였고, Nikawa 등[14]은 in vitro에서 L. reuteri 함유비율에 따른 S. mutans의 감소를 관찰하였다. 또한, Caglar[15] 등은 L. reuteri ATCC 55730을 첨가한 빨대 사용 및 정제를 3주간 복용하였을 때 타액 내 S. mutans 수가 감소했으며, 요구르트에 L. reuteri를 첨가하여 2주간 복용하는 실험에서 L. reuteri 함유 요구르트 복용이 타액 내 S. mutans 수를 감소시켜 치아우식 위험을 줄이는 긍정적인 효과를 보인 연구결과와 차이를 나타내었다[14]. 이는 in vitro에서 L. reuteri Probiotics가 S. mutans 억제 효과를 나타내기에 충분한 균수를 이루지 못하였기 때문이라고 사료된다.
Biofilm 형성에서 L. reuteri Probiotics는 낮은 농도(2.5%)에서도 biofilm 형성이 억제되는 양상을 보였으나, 농후 발효유의 경우에서도 높은 농도(5, 10%)에서 유의미하게 biofilm 형성이 억제되는 양상을 보여 Probiotics에 포함된 균의 종류에 따라 정도의 차이는 있지만 biofilm 형성을 억제하는 효과를 나타내는 것으로 보인다. 이는 Söderling 등[20]의 연구에서 L. reuteri PTA 5289에 의한 biofilm 형성 억제효과를 보인다는 연구결과와 유사함을 보였다. 본 연구결과에서 대조군과 비교하여 농도별 biofilm 감소량의 차이가 나타난 이유는 타액으로 코팅된 Hydroxyapatites에 Probiotics가 결합하여 S. mutans의 부착을 감소시켰기 때문일 것으로 사료된다[21].
본 연구에 사용된 L. reuteri Probiotics 초기 산도를 측정한 결과, L. reuteri Probiotics의 pH는 5.94로 조사되었고, 이는 Stephan 이론에 의하면 pH 5.0 이하의 농도에서 치아표면의 탈회가 일어날 수 있다는 Stephan 곡선에 의한 우식발생 가능 범주에 해당되지 않으며, Sissons 등[22]은 치면세균막 내 S. mutans의 pH 농도가 5.5이하로 떨어지면 치아가 우식될 수 있음을 보고하였다. 타액에 산을 첨가함에 따라 생기는 산도 변화에 저항하는 능력을 완충능이라 정의하고, 본 연구에서 L. reuteri Probiotics의 완충능이 높게 관찰되어 구강 내 pH 7로 중화되기 쉬움을 보여 치아우식의 위험도가 낮음을 것으로 생각된다. Katz 등[23]은 타액 완충능 뿐만 아니라 식품 고유 완충능 또한 구강 내 타액 및 플라그 형성에 영향을 줄 수 있다고 하였고, 허 등[24]은 고유 pH가 중성에 가깝고 식품의 고유 완충능이 높으면 식품 자체가 구강 내 산도를 중화시킬 수 있어 탈회를 예방할 수 있다고 보고하여 본 연구결과를 지지한다. 또한, 본 연구에서 각 용액에 S. mutans를 접종 후 8시간 배양하여 산생성능을 평가한 결과, 6시간 경과 시 농후 발효유는 pH 5.5 이하를 나타내 탈회임계점을 넘어섰고, L. reuteri Probiotics는 pH 6.5로 중성에 가까운 수치를 보여 유산이 생성되어 pH 변화가 큰 농후 발효유와 달리 L. reuteri Probiotics에 함유된 Probiotics에서 유당의 분해가 이루어지지 않아 산생성능의 변화가 적은 것으로 생각된다[25].
치주균인 A. actinomycetemcomitans의 사멸 정도를 관찰한 결과 L. reuteri Probiotics가 A. actinomycetemcomitans 감소하는 양상을 관찰하였으며, Krasse 등[26]은 L. reuteri 정제 2주 복용 후 중등도에서 중증의 치은염 환자에서 치은 지수 및 플라그 지수를 감소를 보고하여 본 연구결과를 지지한다. Twetman 등[27]은 L. reuteri ATCC 55730 및 ATCC PTA 5289가 함유된 껌을 2주 동안 1일 10분 이상 씹을 경우, 씹는 기간 동안 BOP (bleeding on probing) 개선 및 GCF (gingival crevicular fluid) 양의 유의미한 감소효과를 보고하였다. Vivekananda 등[28]은 SRP (scaling+root planing) 치료와 함께 42일 동안 L. reuteri Probiotics 정제 복용 후 A. actinomycetemcomitans 90% 이상의 사멸 효과를 보인다는 연구결과와 유사함을 보였다. 이것은 L. reuteri가 우식유발균으로 알려진 S. mutans에 의한 치태형성 억제 및 치주질환 유발균인 A. actinomycetemcomitans 형성을 억제한 긍정적인 영향을 보이며, 장관계(장내)에 효능이 입증된 Probiotics가 구강 병원균을 억제하는 목적으로 활용될 수 있음을 보여준다고 사료된다.
본 연구의 제한점으로는 L. reuteri 함유 Probiotics의 특정 제품을 선택하여 평가한 in vitro 연구로 특정 제품에 함유된 합성물에 의한 변수가 있었을 것으로 생각된다. 이에 향후에는 시중에 판매되는 다양한 제품의 L. reuteri 함유 Probiotics를 사용하여 플라그 형성 및 구강 질환발생에 대한 L. reuteri Probiotics의 효과를 비교분석하고 제품에 포함된 다양한 합성물의 차이를 분석하는 구체적인 연구가 필요할 것으로 생각된다. 또한, 본 연구결과에서 S. mutans 감소 효과가 없었던 이유는 L. reuteri Probiotics와 S. mutans 희석 비율이 낮은데서 기인한 것으로 L. reuteri Probiotics가 S. mutans 억제 효과를 나타내기에는 충분한 균수에 도달하지 못했을 것으로 생각되며, 이는 사용한 특정 제품에 함유된 균수가 변수로 작용하였을 것으로 판단된다. 이에 Probiotics에 함유된 유익한 균들이 구강환경에서 영향력을 미치는지 정제형 Probiotics와 껌 type 중 어느 것에 더 유의성이 있는지 검증이 필요할 것으로 생각되며, 향후 이에 관한 추가적인 연구가 더 진행되어야 할 것으로 사료된다. 이러한 연구 제한점에도 불구하고 본 연구는 L. reuteri 함유 Probiotics가 치주질환을 유발하는 구강미생물의 증식이나 biofilm 형성에 미치는 영향 및 산도와 완충능, 산생성능 측정을 통해 우식유발능을 평가함으로써 구강질환 예방 및 증진을 위한 보조제로서의 L. reuteri 함유 Probiotics 활용에 대한 기초자료를 제공할 수 있을 것으로 생각된다.
결론
시판되는 농후 발효유와 L. reuteri 함유 Probiotics를 선택하여 구강미생물의 증식이나 biofilm 형성에 미치는 영향을 평가하고, 각 용액의 산도와 완충능, 산생성능을 측정하여 다음과 같은 결과가 관찰되었다.
1. S. mutans의 생균수 측정한 결과, 농후 발효유 8×106 CFU/ml, L. reuteri Probiotics 318×106 CFU/ml, 대조군 342×106 CFU/ml로 관찰되었으며, 농후 발효유에서 대조군과 L. reuteri Probiotics에 비해 유의미하게 S. mutans 억제 효과를 보였다(p<0.05).
2. 농도별 A. actinomycetemcomitans 흡광도 측정결과, 농후 발효유의 경우 농도가 증가할수록 높은 흡광도(optical density)를 나타내어 A. actinomycetemcomitans 생장이 유의미하게 증가하는 양상을 보인 반면, L. reuteri Probiotics의 경우 각 농도에서 농후 발효유와 비교 시 유의미하게 낮은 흡광도를 나타내어 A. actinomycetemcomitans 생장이 억제됨을 관찰하였다(p<0.01).
3. Biofilm 형성 실험결과, L. reuteri Probiotics와 농후 발효유에서 대조군과 비교하여 낮은 흡광도를 나타내어 biofilm 형성이 유의미하게 억제되는 양상을 보였다(p<0.01). 특히 2.5%의 L. reuteri Probiotics 낮은 농도에서도 농후 발효유보다 현저하게 biofilm 형성이 억제됨을 관찰하였다(p<0.01).
4. 초기 산도는 농후 발효유(4.24±0.01)가 가장 낮았으며, L. reuteri Probiotics (5.94±0.13), 대조군(7.24±0.04) 순으로 유의미한 차이를 보였다(p<0.01).
5. 완충능 측정결과 대조군, L. reuteri Probiotics, 농후 발효유 순으로 높게 나타났고, L. reuteri Probiotics와 농후 발효유의 유의한 차이를 보였다(p<0.05).
6. 산생성능을 평가하기 위해 pH 7로 중화시킨 후 S. mutans를 접종하여 배양하고 2시간 간격으로 산도를 측정한 결과, 6시간 경과 시 농후 발효유는 pH 5.5 이하로 감소하였으나, L. reuteri Probiotics는 pH 6.6으로 유지되어 산생성능에 의한 pH 변화에서 집단 간의 유의한 차이가 있었다.
이러한 결과는 L. reuteri 함유 Probiotics가 biofilm 형성, 초기 산도 및 산생성능을 적게 유도하며, 치주질환을 유발하는 A. actinomycetemcomitans의 감소에 긍정적인 영향을 나타내었다. 따라서 본 연구는 L. reuteri 함유 Probiotics의 유익한 효과를 고려할 때 구강질환의 예방 및 촉진을 위한 보조제로 구강질환을 줄일 수 있음을 시사한다.