서론
구강암은 악성종양으로 세계에서 발병률이 6번째로 높은 흔한 암으로 다른 암들에 비해 악성도가 높고 조기사망률이 매우 높아 5년 생존률이 매우 낮은 암으로 알려져 있다[1-3]. 구강암의 종류로는 편평 상피세포암 종이 90% 이상으로 가장 흔하고 그 밖에 구강의 침샘에서 발생하는 타액선암, 턱뼈에 발생하는 육종(sarcoma), 드물게 발생하는 림프종(lymphoma), 흑색종(melanoma) 등이 있다. 악성 점액표피양암종 (mucoepidermoid carcinoma, MEC)은 타액선 암중에서 가장 흔한 악성 상피 암이다. 두경부암의 약 15%, 타액선 악성 종양의 약 30%를 차지하고 있다[4-6]. 편평상피암 종에서 화학적 약물을 이용한 많은 항암효능연구들이 있지만 악성 점액표피양암종에서는 많은 연구가 이루어져 있지 않다[2,7]. 최근 연구에서는 구강암의 치료법 중 화학적 약물치료의 부작용 한계점이 있어 천연추출물들을 통한 항암 효능이 있다고 보고된 바 있다[4,7-9].
오래전부터 천연추출물은 질병의 치료제로서의 용도에 대한 관심이 많아지면서 화학적 약물들에 비해 독성이 적어 여러 치료제로서 사용되어 왔다[10-12]. 특히 천연추출물은 각종 암 치료제로서 중요한 역할을 한다고 연구되어 있다[13-15]. 천연추출물 중에 하나인 실망초(erigeron bonariensis)는 국화과(compositae) 망초속(conyza, erigeron linne)에 속하는 귀화식물로 원산지는 남아메리카의 북반구 지역이며, 우리나라에서는 기후 변화에 의해 온도 상승이 높은 남부지방과 제주도에 주로 분포하는 것으로 알려져 있다[16]. 아시아의 전통의학에서는 해열, 해독작용, 항염증작용 등의 효능을 이용해 다양한 질환을 치료하기 위해 폭넓게 응용되고 있다[17]. 실망초의 꽃은 위장장애의 국소적 치료제로 사용되고, 잎은 신경완화제로 사용되며 뿌리는 설사와 이질치료 약제로 사용된다고 보고되어 있다[18]. 또한 다양한 암세포에서 항암효능이 있다고 입증되어 있다[19,20]. 최근에는 천연추출물을 이용한 암 치료 연구가 활발하게 진행 중이다. 하지만 이러한 많은 연구들 중에서도 실망초에 대한 사람의 구강암에서의 효능연구는 밝혀진 바가 없다.
이에 본 연구는 천연추출물 중에 하나인 실망초 메탄올 추출물(MEEB)을 사용하여 사람의 다양한 구강암 중에 MEC 세포주의 종류인 MC3와 YD15에서 세포생존 억제 효능 및 세포사멸 효능을 통해 MEEB의 항암효능을 확인하고자 하였다.
연구방법
1. 연구재료
1) 세포배양 및 연구재료
본 실험에서는 타액선 암 중에 점액표피암종(MEC)에 대한 구강암예방효능을 확인하고자 MEC cell lines 중 일부 연구가 되어 있는 사람 구강암 세포주인 MC3 세포와 YD15 세포를 사용하였다. MC3 세포는 Fourth Military Medical University(Xi’an University, China)으로부터, YD15 세포는 연세대학교 치과대학 구강병리학교실 (Yonsei University, Seoul, Korea)로부터 분양받았다. MC3 세포는 Dulbecco’s Modified Eagle’s Medium(DMEM) 배지를, YD15 세포는 Roswell Park Memorial Institute(RPMI) 배지를 사용하였고, 10% Fetal bovine serum(FBS)와 100 µ/mL의 penicillin과 streptomycin를 포함 한 두 배지는 모두 37℃, 5% CO2배양기(CO2 Incubator, VISION Scientific, Korea)에서 계대 배양하여 사용하였다. 세포배양을 위해 사용된 DMEM, RPMI 배지와 FBS는 웰진으로부터 구입하였다(Welgene, Daegu, Korea). 항체(antibody)들 Cleaved PARP는 Cell Signaling Technology(Danvers, MA, USA)으로부터 제공받았고 Actin 항체는 Santa Cruz Biotechnology(Santa Cruz, CA, USA)로부터 구입하여 사용하였다. 한국식물추출은행으로부터 제공받은 20개의 천연추출물은 DMSO 100 mg/mL에 용해되었고, 용매제로 사용한 DMSO의 최종농도는 0.1%를 초과하지 않았다. DMSO에 용해된 천연추출물들은 구강암세포주에 20 μg/mL의 농도로 처리하였다 <Table 1>.
2. 연구방법
1) 세포 생존률(viability) 측정
MC3 세포는 6-well plate에 2.2×105, YD15 세포는 60 mm dish에 8×105의 조건으로 세포를 분주한 배지에 Cell이 50~60% 성장하였을 때 0.1% Dissolved in dimethyl sulfoxide(DMSO)로 대조군에 처리하였고 5 μg/mL, 10 μg/mL, 20 μg/mL, 40 μg/mL의 농도로, YD15세포에는 5 μg/mL, 10 μg/mL, 20 μg/mL, 40 μg/mL, 80 μg/mL의 농도로 각각 48시간 동안 처리 후 생존한 세포의 생존률을 확인하였다. MEEB는 5% FBS가 포함된 DMEM과 RPMI 배지에서 48시간 처리 후 Neubauer’s chmber(hemocytometer)를 통해 세포의 수를 계측하였다. 세포는 Phosphate buffered saline(PBS)로 세척하고 Trypsin용액(Welgene, Daegu, Korea)처리 후 800 rpm, 3분 원심분리하여 세포를 수거하였다. 남아있는 세포에 PBS를 1 mL넣고 피펫으로 섞어준 후 Hemocytometer를 사용해서 전체 세포의 수를 세어 생존률을 측정하였다. 모든 실험은 Triplicate로 세번씩 실험하였다.
2) Western blot 분석법
MC3와 YD15 세포는 60 mm2와 10 cm dish에 분주하고 DMSO와 MEEB를 농도별로 처리하였다. 단백질 정량을 위해 세포는 Lysis buffer와 DC 단백질 분석법(Bio-RAD Laboratories. Hercules, CA, USA)을 사용하였다. 단백질 sample들은 SDS-polyacrylamide gel로 전기영동을 통해 분리 후 PVDF membrane(Bio-RAD)을 이용하여 이동시켰다. 세포사멸이 일어나면 여러 가지 자극에 의하여 Mitochondria가 활성화 되고 Mitochondria에서 방출되는 여러 단백질들의 활성에 의해서 세포사멸이 일어난다고 알려져 있다. 세포사멸 유도 단백질 중 Poly(ADP-ribose) Polymerase-1(PARP-1)은 세포사멸의 대표적인 분자기전으로 알려져 있다[21]. 이를 확인하기 위해 Membrane을 5% skim milk에 상온 90분간 고정시킨 후 1차 항체인 Cleaved PARP, Actin은 4℃에서 overnight으로 배양하였다. Tris buffered saline containing Tween-20(TBST)로 세척 하고 A horseradish peroxidase(HRP)를 결합한 2차 항체를 90분간 실온 배양하였다. 단백질을 확인하기 위해 Eletrochemiluminescence(ECL)용액(Santa Cruz Biotechnology. USA)을 사용하였다.
3. 통계분석
모든 실험결과는 3회 이상 반복 측정하였고 평균과 표준편차를 산출한 후, 대조군과 치료군 간의 차이의 중요성을 결정하기 위해 통계분석은 t-test 분석법을 통해 분석하였다. 본 연구의 분석에 사용한 통계프로그램은 GraphPad prism version 4를 이용하였고, 통계적인 유의수준은 0.05로 하였다.
연구결과
1. MC3 세포에서 여러 천연추출물들의 세포성장 억제 효과
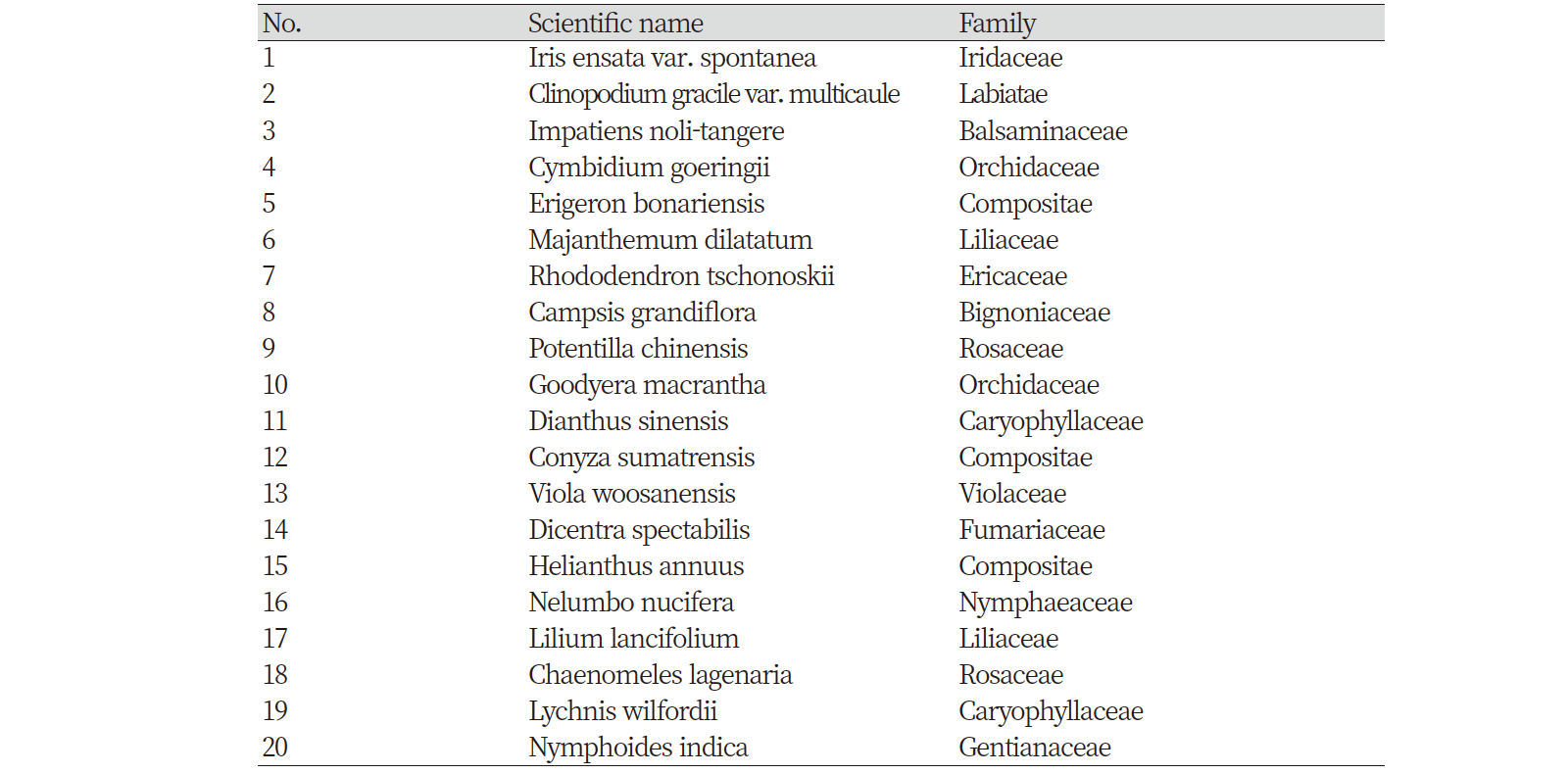
구강암 세포주인 MC3 세포에서 천연추출물 20개의 세포성장 억제 효과를 확인하기 위해 세포 계수법을 통하여 실험하였다<Fig. 1>. 한국식물추출은행으로부터 제공 받은 20개의 천연추출물들을 20 μg/mL의 농도로 구강암 세포주인 MC3 세포에 48시간 동안 처리하여 세포의 성장률을 확인하였다<Fig. 1>. Trypan blue 분석법을 사용하여 세포계수 결과, MC3 세포에서는 12개의 천연추출물에서 대조군과 비교하여 생존해 있는 MC3 세포의 수가 유의성 있게 감소하였다(#3, #5, #6, #7, #8, #9, #11, #12, #16, #17, #19, #20)(p<0.05).
이들 중 MC3 세포에서 공통적으로 가장 많은 세포성장률을 억제한 천연추출물은 #5 Erigeron bonariensis로 실망초 메탄올 추출물(MEEB)이었다.
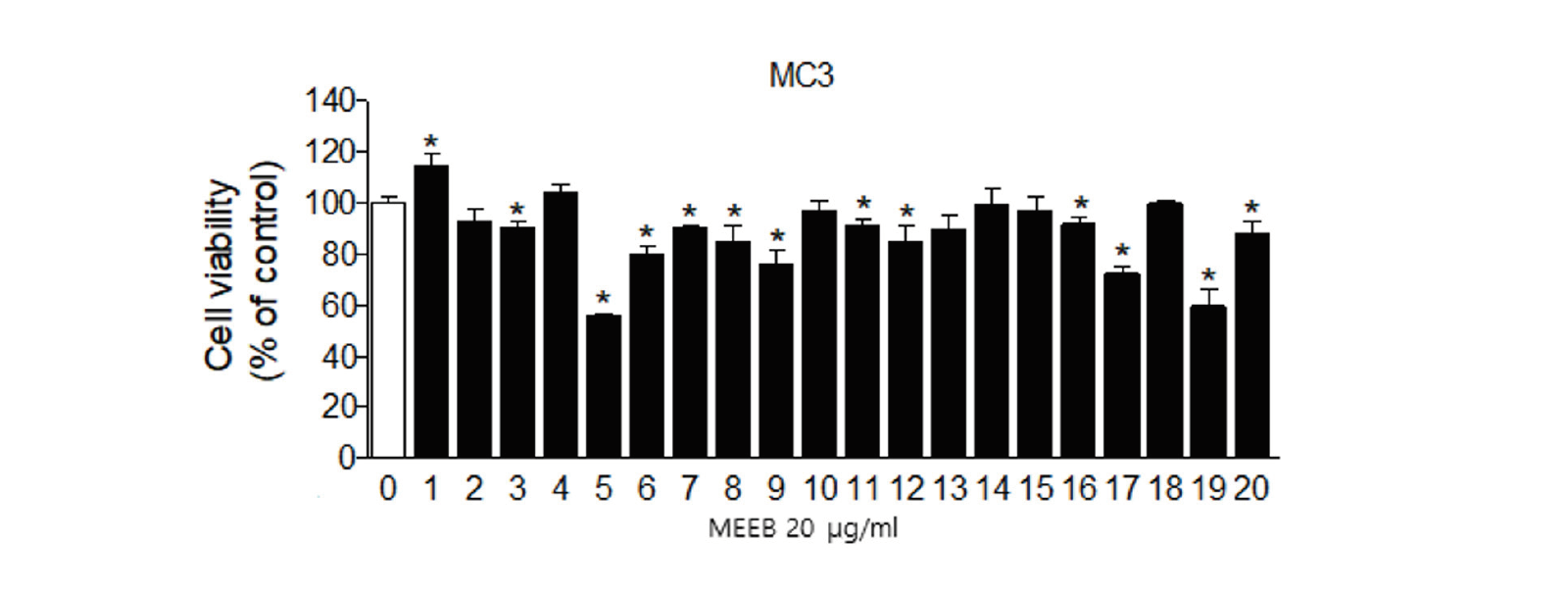
Fig. 1. The effect of sundry natural products on cell viability in MC3 cells The graph represent of three independent experiments of MC3 cells. Cells were treated by dimethyl sulfoxide (DMSO; vehicle control, White bar) or methanol extracts of 20 various natural products 20 μg/mL for 48 hours (#1-20, Black bar), and cell viability were analyzed as trypan blue exclusion assay (0.4%). The graph is mean±SD. *p<0.05, Significance compared with the vehicle control-treated group
2. 실망초 메탄올 추출물(MEEB)에 의한 구강암 세포주인 MC3 세포와 YD15 세포의 세포 증식 억제 효과
구강암의 종류 중 점액표피암종(MEC) 세포주인 MC3 세포와 YD15 세포에서 MEEB의 세포성장 억제 효과를 확인하기 위해 세포 계수법을 통하여 세포 생존률을 실험하였다<Fig. 2>. MEEB를 MC3 세포에 5 μg/mL, 10 μg/mL, 20 μg/mL, 40 μg/mL의 농도로, YD15 세포에는 5 μg/mL, 10 μg/mL, 20 μg/mL, 40 μg/mL, 80 μg/mL의 농도로 각각 48시간 동안 처리 후 생존한 세포의 수를 계측하였다. 세포 계수 결과, MC3 세포에서는 5 μg/mL, 10 μg/mL, 20 μg/mL, 40 μg/mL의 농도 처리하였을 때 대조군과 비교하여 생존해 있는 MC3 세포의 수가 유의성(p<0.05) 있게 감소하였고, YD15 세포에서는 20 μg/mL, 40 μg/mL, 80 μg/mL의 농도 처리하였을 때 대조군과 비교하여 생존한 YD15 세포의 수 또한 유의성(p<0.05) 있게 감소하였다. 이를 통해 알 수 있었던 점은 MEEB는 구강암 세포주인 MC3와 YD15의 세포증식을 억제시키는 효과적인 물질임을 확인할 수 있었다.
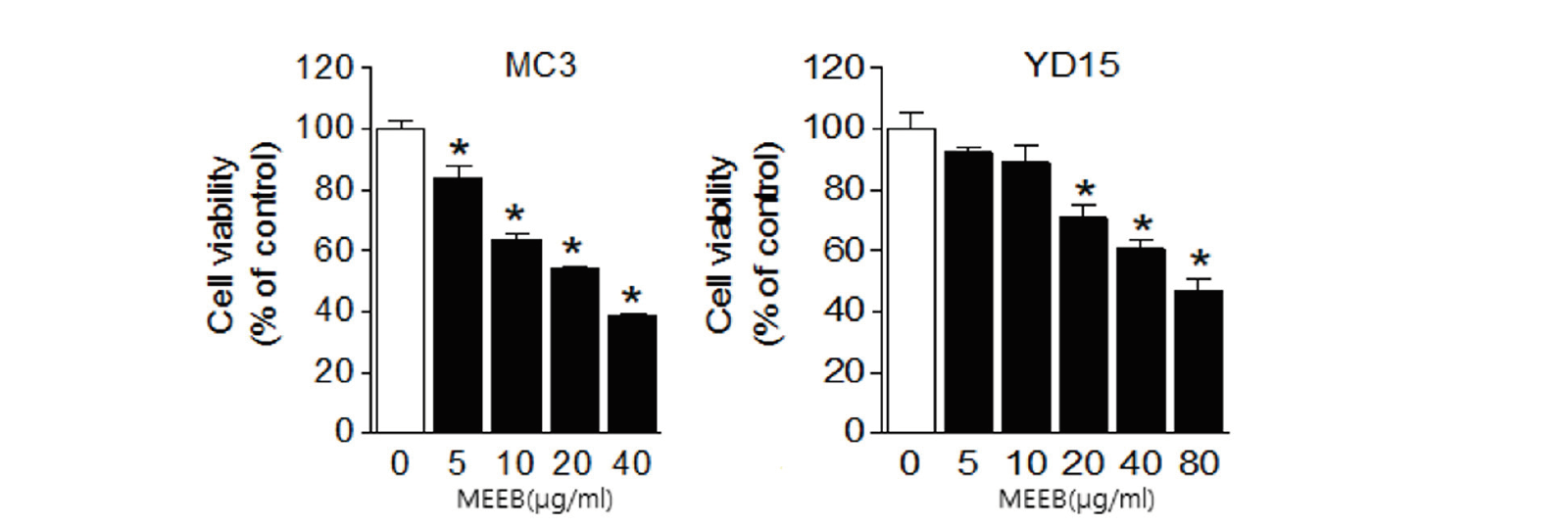
Fig. 2. The effect of erigeron bonariensis (MEEB) on cell viability in human oral cancer cell lines The effects of MC3 cells YD15 cells were treated MEEB for 48 hours on cell viability were analyzed by trypan blue exclusion assay. Cells were treated by DMSO (White bar) or treated by each concentration for 48 hours (#1-20, Black bar) in MC3 cells (left) and YD15 cells (right). The graph was typical of three independent experiments of MC3 cells (left) and YD15 cells (right). The bar is mean±SD. *p<0.05 as compared DMSO-treated group
3. 구강암 세포에서 실망초 메탄올 추출물(MEEB)의 세포사멸 효과
MC3 세포와 YD15 세포에서 MEEB에 의한 세포사멸을 유도하는지 알아보기 위해 Western blot 분석법을 통하여 cleaved PARP 단백질의 활성을 확인하였다<Fig. 3>. MC3세포에 5 μg/mL, 10 μg/mL, 20 μg/mL, 40 μg/mL의 농도로, YD15 세포에는 5 μg/mL, 10 μg/mL, 20 μg/mL, 40 μg/mL, 80 μg/mL의 농도로 각각 48시간 동안 처리하였다. 그 결과 대조군에 비하여 구강암 세포주에 MEEB를 처리하였을 때 cleaved PARP 단백질의 활성이 증가되었다<Fig. 3>. 이는 MEEB 처리에 의한 구강암세포의 성장 억제는 세포사멸을 일으키는데 밀접한 관련이 있음을 알 수 있었다.
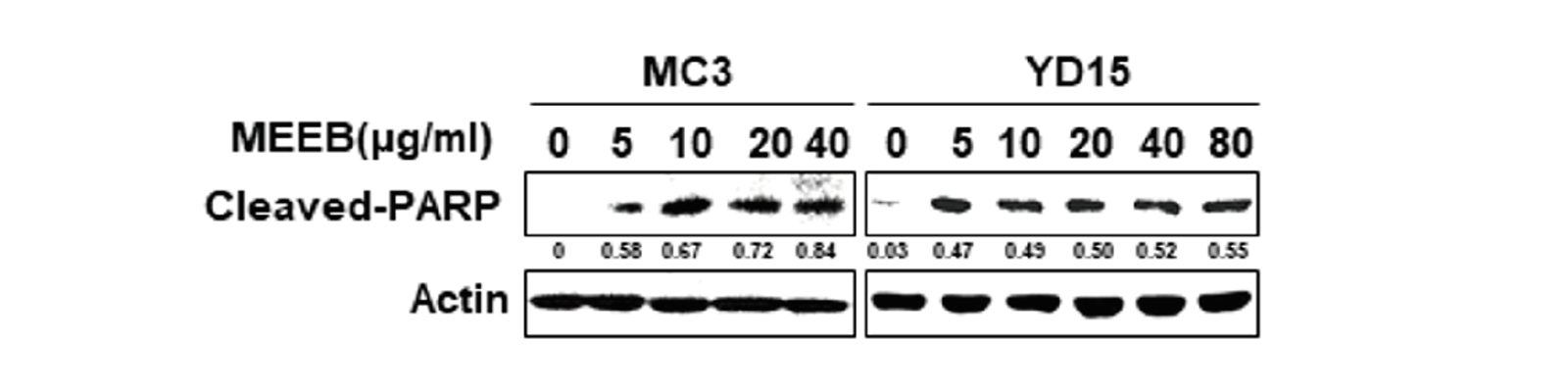
Fig. 3. The apoptotic effect of Erigeron bonariensis (MEEB) in MC3 cells YD15 cells The apoptotic effects of MC3 cells YD15 cells were treated using dimethyl sulfoxide or various concentrations of MEEB for 48 hours. The apoptotic effect of MEEB was decided through Western blot analysis using the antibodies against cleaved poly ADPribose polymerase (PARP) in MC3 cells (left) and YD15 cells (right). Actin was used as internal control
총괄 및 고안
구강암을 비롯한 다양한 암을 치료하기 위한 방법들을 살펴보면, 면역치료, 예방치료, 방사선치료, 대체요법, 외과적 수술 그리고 화학 예방요법 등이 있다. 그중에서도 외과적 수술이 주로 사용되고 있기는 하지만, 외과적 수술을 비롯한 다른 다양한 치료방법들을 시행했을 시 부작용과 수술 후 비 심미적인 환자의 상태나 기능장애를 초래할 수 있는 확률들이 높다[4,7]. 따라서 많은 연구자들에게서 천연추출물들을 이용한 치료법이 연구의 대상으로 알려지고 있으며, 다양한 천연추출물들이 실제로 암세포에 대한 세포독성 효과 및 암예방 효과를 가지고 있다고 밝혀져 있는 상태이다[22,23]. 이전 연구에 따르면 여러 구강암 세포주에서 천연추출물은 구강암의 세포 생존을 억제하여 항암효능이 있다고 알려져 있다[7-9]. 항암제 연구에서 암세포에 대항하여 세포 생존 활동을 측정하는 실험은 항암제의 효능을 입증하는 사전 및 임상 심사 평가에 중요한 요소 중에 하나이다. 따라서 본 연구에서는 먼저 구강암 세 포주 중에 하나인 MC3 세포에서 한국천연추출물은행에서 제공받은 20개의 천연추출물들에 의한 세포성장 억제 효과를 확인해 보았다. 그 결과 MC3 세포에서 공통으로 20개의 천연추출물들 중에 #5 Erigeron bonariensis 인 실망초 메탄올 추출물(MEEB)에 의한 세포 생존 활동이 대조군에 비해 가장 많이 감소함을 확인할 수 있었다<Fig. 1>.
실망초는 남아메리카 원산의 국화과 귀화식물로 아시아의 치료의학에서는 많은 질병들의 치료약제로 사용되고 있다[17]. 또한 MEEB는 여러 암에서 항암효능이 입증되어 있는데, 인간 폐선암 세포주인 A549 및 H1299 세포에서 세포독성 효과를 입증하여 잠재적인 항암효과가 있다는 보고가 있다[19]. 이전연구 결과들을 바탕으로 구강암세포에서도 MEEB에 의한 항암효과가 있는지 확인해보고자 하였다. <Fig. 1>의 실험결과를 바탕으로 구강암 세포주인 MC3 세포와 YD15 세포를 선택하여 MEEB의 항암효능에는 어떠한 영향을 미치는지 연구해보았다. MC3 세포와 YD15 세포에서 MEEB에 의한 세포 생존률을 확인하기 위해 세포계수법을 통해 확인해 보았다. 그 결과, Fig. 2에서 알 수 있듯이 MEEB을 처리하였을 때 대조군과 비교하여 생존한 MC3 세포와 YD15 세포의 수가 유의성 있게 농도 의존적으로 감소하는 것을 확인하였다(p<0.05). 이전연구들에 의하면 구강암의 세포성장을 억제시키는 분자학적 기전으로 세포사멸과 관련이 있다고 알려져 있다[15,17-19]. 세포사멸의 한 형태인 Apoptosis는 항암제에 의한 세포 독성에서 중요한 현상이다. 프로그램 된 세포사멸은 일련의 단백질 및 유전자 조절과 세포 신호 전달 경로에 의해 매개되는 생화학적 변화로 세포 밖 또는 세포 내에서 이루어진다. 세포 내에서 세포사멸이 일어나면 여러 가지 자극에 의하여 Mitochondria가 활성화 되고 Mitochondria에서 방출되는 여러 단백질들의 활성에 의해서 세포사멸이 일어난다고 알려져 있다. 그만큼 Mitochondria apoptotic 통로는 세포 죽음에 있어 중추적인 역할을 한다. 미토콘드리아에 의한 세포사멸 유도 단백질 중 poly (ADP-ribose) polymerase-1 (PARP-1)은 세포사멸의 대표적인 분자기전으로 알려져 있다 [24,25]. 따라서 본 연구에서는 MEEB의 세포성장 억제가 세포사멸과 관련 있는지 알아보기 위해 세포사멸의 대표적인 분자기전으로 알려진 cleaved PARP 단백질의 발현을 Western blot 분석법을 통하여 확인해 본 결과 두 구강암세포주에서 세포의 성장이 감소한 것과 동일하게 cleaved PARP 단백질의 발현이 증가하였다. 이는 MEEB에 의해 세포사멸이 유도되어 구강암세포 성장이 억제되었다는 밀접한 관련이 있음을 알 수 있다. 따라서, 이러한 결과를 종합해 볼 때, MEEB는 구강암 예방효능에 대한 잠재적으로 발전 가능성이 있는 천연추출물이 될 것으로 보인다. 하지만, 본 연구의 제한점으로는 천연추출물을 이용하여 구강암 세포주에서 세포생존률 억제 및 세포사멸 효능만을 확인하였기 때문에 사람의 구강암 예방 약물로 정확히 판단하기에는 한계가 있다. 따라서 한계점을 보완하기 위해서는 동물 실험 및 임상실험으로 확대하여 구강암 예방을 위한 약물 개발을 위한 후속 연구가 필요할 것으로 사료된다. 이러한 후속연구들을 통해 MEEB가 구강암 예방을 위한 표적항암제로 발전할 수 있는 계기가 되길 바란다.
결론
한국식물추출은행으로부터 제공받은 천연추출물 20개를 사람 구강암세포주인 MC3 세포에 20 μg/mL의 농도로 48시간 동안 처리한 후 세포 생존률과 세포사멸 효능을 확인해 본 결과 다음과 같은 결과가 관찰되었다.
1. 두 세포주에서 공통적으로 MEEB를 처리하였을 때 대조군에 비해 생존해 있는 구강암세포의 수가 유의성 있게 감소하는 결과를 확인하였다(p<0.05).
2. MC3 세포에 5 μg/mL, 10 μg/mL, 20 μg/mL, 40 μg/mL의 농도로, YD15 세포에는 5 μg/mL, 10 μg/mL, 20 μg/mL, 40 μg/mL, 80 μg/mL의 농도로 48시간 처리한 결과, MEEB은 구강암 세포주의 세포성장은 유의성 있게 감소되었고, 세포사멸의 대표적인 분자기전 단백질 중 하나인 poly (ADP-ribose) polymerase-1 (PARP-1) 발현은 대조군과 비교하여 MEEB를 처리하였을 때 증가하였다.
따라서, 전체적인 결과를 종합해 볼 때, 실망초 메탄올 추출물(MEEB)은 구강암 예방효능을 가진 잠재적인 발전 가능성이 있는 천연추출물이 될 것으로 사료된다.