1Department of Dental Hygiene, Hallym Polytechnic University
2Department of Dental Hygiene, Hanseo University
Correspondence to Min-Kyung Kang, Department of Dental Hygiene, Hanseo University, 6 Hanseo 1-ro, Haemi-myeon, Seosan-si, 31962, Korea. Tel: +82-41-660-1575, Fax: +82-41-660-1579, E-mail: kmk0709@hanseo.ac.kr
Volume23, Number 6, Pages 459-66, December 2023.
J Korean Soc Dent Hyg 2023;23(6):459-66. https://doi.org/10.13065/jksdh.20230051
Received on October 08, 2023, Revised on December 12, 2023, Accepted on December 25, 2023, Published on December 30, 2024.
Copyright © 2024 Journal of Korean Society of Dental Hygiene.
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License(http://creativecommons.org/licenses/by-nc/4.0)
Objectives: The purpose of this study was to evaluate the physical properties and antibacterial activity of denture base resin with added silver sulfadiazine. Methods: Specimens were made from self-curing denture base resin and silver sulfadiazine as an inorganic antibacterial agent. For physical evaluation of the specimens, surface roughness, surface hardness, and contact angle were measured. Bacterial growth was assessed by optical densityat 600 nm (OD600) and colony forming units (CFU) measurements to confirm antibacterial activity. Results: There was no significant difference in surface roughness, surface hardness, and contact angle in the experimental group containing silver sulfadiazine compared to the control group. In contrast, the experimental group showed a significant decrease in antibacterial activity compared to the control group in terms of OD value. Analysis of CFU confirmed a significant decrease in colonies in the experimental group compared to the control group. Conclusions: Denture base resin containing silver sulfadiazine, an inorganic antibacterial agent, exhibited enhanced antibacterial activity without physical changes. In conclusion, the use of denture base resin containing inorganic antibacterial agents may be expected in the future.
Antibacterial effect, Denture base resin, Physical property, Silver sulfadiazine
구강 내 형성된 바이오 필름은 치아는 물론 교정 장치, 가철성 의치를 포함한 구강 내 보철물 등에 존재하며, 바이오필름을 형성하는 세균은 치아우식증이나 내독소로 의한 치주질환 등 감염성 구강 질환을 유발시킨다[1]. 고령화에 따라 가철성 의치 장착자의 비율은 점차 증가하고 있으며, 의치 사용에 따른 구내염과 바이오 필름 관련 구강 내 감염병 역시 증가하고 있다[2]. 또한 노인은 타액 분비 감소로 인한 구강 건조증이 유발된다. 이러한 구강 건조증은 구강 내 통증을 유발하고 틀니에 대한 부적응이나 맛에 대한 민감성 감소 그리고 치은염, 치주염, 구강 캔디다증 타액선염과 같은 구강 내 감염을 증가시킨다. 더욱이 고령층에서 복용하는 뇌졸중, 관절염, 정신병 등의 일부 약물들은 구강건조증이나 운동장애를 초래하여 구강건강관리를 복잡하게 만들 수 있으며[3,4], 이러한 구강 내 감염병은 폐렴성 감염 등 노인의 전신질환 위험성을 증가 시킨다[5–7].
의치 관리를 위해 가장 많이 사용되고 있는 세정제 등의 항진균 활성[8]은 세정제 적용 전후에 일시적으로 나타난다. 따라서 세정제를 지속적으로 구입해야 하는 비용과 의치를 세정제에 적용해야하는 번거로움이 존재하고 있다. 특히 의치상용 레진에 많이 침착하며 면역력이 약한 노인의 구내염을 유발 시키는 C. albicans 균에 대한 항균 의치상용 레진의 개발은 아직 미미한 실정이다.
기존 연구에서는 구강 내 바이오 필름 형성을 억제하고자 항생제를 사용하여 항균력을 가진 수복 및 보철재료를 개발하고자 하였으나 재료의 물성 저하, 생물학적 안정성 등의 문제점이 발생하였다[9–11]. 한편, 무기 항균 입자들은 항생제의 내성과 같은 부작용이 없으며, 적은 양으로도 높은 항균활성 효과를 가질 수 있어 구강 내 바이오필름 형성 억제에 있어 좋은 대안이 될 수 있음을 제안하였다[12]. 무기 항균제 중 은(Ag)은 미생물 세포막의 구성물과 반응함으로써 세포막 손상을 통한 항균 메커니즘을 가지고 있으며 치과재료에 은을 혼합하여 사용할 경우 내구성이 좋아 이를 임상에서 사용하기 적당한 재료임을 증명하였다[13–15]. 특히 실버 설파다이아진은 설파 타이아진의 은유도체로서 많은 그람양성 및 음성 세균에 대하여 살균 작용을 가지고 있으며, 화상환자의 창상패혈증 예방과 치료에 국소 항감염제로도 사용되고 있다[16,17]. 이처럼 항균제를 활용하여 항균효과를 가지도록 하는 치과생체재료의 연구는 많이 연구되고 있는 추세이나, 실버 설파다이아진을 활용하여 의치상용 레진 등 보철재료에 적용한 연구는 미비한 실정이다.
따라서 본 연구의 목적은 의치상용레진에 실버 설파다이아진을 첨가시켜 항균력을 평가하고 재료의 물성을 평가하여 의치상용 레진과 같은 보철재료 내 항균 재료로서 실버 설파다이아진 활용 가능성을 평가하고자 하였다.
본 연구의 의치상용레진은 자가중합형 의치상용레진(Jet Denture Repair, Lang Dental, USA)을 사용하였으며, 무기 항균제 은으로는 실버 설파다이아진으로(Silver sulfadiazine, Sigma Aldrich, USA)을 사용하였다.
시편제작을 위해 <Table 1>과 같은 비율로 레진 파우더와 실버 다이아진을 먼저 혼합하고 제조사의 지시에 따라 레진 용액을 첨가하여 Speed mixer (DAC 150.1 FVZ, Hauschild, Germany)를 사용하여 1분간 최종 혼합 후 지름 12 mm, 두께 2 mm인 테프론 몰드에 주입하여 제작하였다. 이때, 표면을 편평하게 만들고 재료가 접착되지 않도록 폴리에틸렌 필름과 slide glass를 몰드 위에 위치시키고 15분간 경화시켰다. 완전 경화가 된 후 시편을 몰드에서 분리하도록 하였다.
Table 1. The composition of antibacterial denture base resin containing silver sulfadiazine
| Materials | Powder of resin (wt%) | Silver sulfadiazine particle (wt%) |
|---|---|---|
| Control | 100 | 0 |
| Exp. 1 | 99 | 1 |
| Exp. 2 | 98 | 2 |
| Exp. 3 | 97 | 3 |
표면 거칠기는 비접촉 방식의 광학적 표면 거칠기 측정기(GT-X3 BASE GTX-12-121, Brucker, USA) 이용하여 VSI모드에서 측정하였다. 표면조도를 측정하기 위한 지표로 Ra (Average roughness)값을 기록하였다. 각 실험군의 시편 당 3회 측정하여 평균을 구하였다. Ra는 기록된 표면 조도 곡선 상에서 중심선 상부면적과 하부 면적의 합이 최소가 되는 중심선을 설정하고 이 중심선으로부터 조도곡선까지의 수직거리에 대한 산술평균값으로 치과 영역에서 가장 널리 사용되는 표면조도 측정지표이다. 표면 경도 측정은 비커스경도기(MMT-X7B, MATSUZWA, Japan)를 사용하여 측정하였다. 대면각 136도의 다이아몬드 피라미드 압입자로 1.0 kgf 하중을 20초간 시편 표면 위에 가한 뒤 측정하였다(N=10).
접촉각 측정은 의치상용 레진 시편 위에 2차 증류수 10 ㎕를 떨어트리고, 접촉각 측정기(Smartdrop_lite,Femtobiomed, Korea)를 사용하여 시편과 증류수간에 형성된 좌, 우의 접촉각의 평균값을 접촉각으로 측정하였다(N=10).
한국생명공학 연구원 생물자원센터에서 동결 건조된 Candida albicans (C. albicans) (ATCC 7965)를 Yeast mold broth (YM broth; BD Difco, Franklin Lakes, NJ, USA)에 풀어 활성화 시킨 뒤 100 μl와 배에 10 ml에 혼합한 다음 37℃의 인큐베이터에서 24시간 활성화 시켰다. 24시간 동안 활성화된 균은 5×104 colony forming unit (CFU)/ml 농도로 만들어 세균액 100 μl을 의치상용 레진 시편 위에 올리고 24시간 동안 37℃의 인큐베이터에서 배양하였다. 배양 후 시편에서 세균 부유액을 시편에서 떨어트리고 부유액 100 μl을 고체 배지에 바르고 24시간 동안 인큐베이터에서 배양한 뒤 형성된 균집락을 계산하여 항균력을 평가하였다<Fig. 1>.
Fig. 1. Antibacterial effect on specimens
레진시편을 증류수에 넣고 ISO 10993-11에 따라 24시간 동안 37℃ 쉐이킹 인큐베이터에서 용출하였다. 그리고 세균액을 5×104 colony forming unit (CFU)/mL 농도로 만든 후 96 well에 100 µL씩 분주하고 그 위에 100 µL씩 용출액을 분주하여 4시간과 24시간 동안 37℃의 인큐베이터에서 보관하였다. 각각 4시간과 24시간 시점이 되면 ELISA reader (Epoch, BioTeck, USA)를 사용하여 600 nm에서 흡광도(OD)를 측정하여 세균활성도를 평가하였다.
정량화된 결과를 기록하고 평가된 결과는 SPSS program (ver. 22.0; IBM Corp., Armonk, NY, USA)프로그램을 이용하여 통계분석을 실시하였다. 비모수 검정방법 중 Kruskal-wallis 검증을 실시하였으며 사후 검증으로 Bonferroni correction method 보정방법을 사용하였다(α=0.05).
비접촉식 광학적 표면 거칠기 측정기로 대조군과 실험군을 측정한 결과, 대조군은 0.29±0.12, Exp 1 그룹은 0.32±0.10, Exp 2 그룹은 0.33±0.12, Exp 3 그룹은 0.32±0.08로 나타났다. 대조군 그룹과 비교하여 1 wt% 그룹, 2 wt% 그룹 그리고 3 wt% 그룹간의 실버 설파다이진이 첨가된 의치상용 레진의 표면 거칠기는 유의한 차이가 없었다(p>0.05)<Fig. 2>.
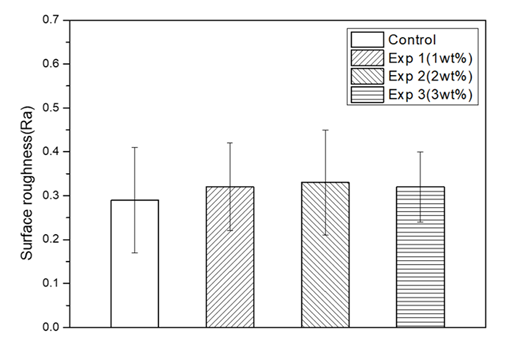
Fig. 2. Result of surface roughness on denture base resin; Control: only denture base resin, Exp 1: 1 wt% experimental material, Exp 2: 2 wt% experimental material, Exp 3: 3 wt% experimental material.
비커스경도기를 이용하여 표면경도를 측정한 결과, 대조군은 11.35±0.16, Exp 1 그룹은 11.8±0.82, Exp 2 그룹은 11.23±0.56, Exp 3 그룹은 11.49±0.54로 나타났다. 의치상용 레진에 무기항균제를 넣어 제작한 실험군과 대조군을 비교하여 실험군의 표면경도는 유의한 차이가 없었다(p>0.05)<Fig. 3>.
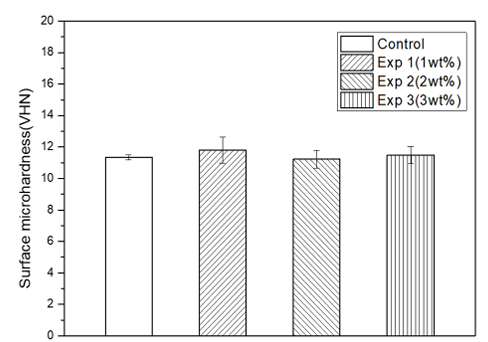
Fig. 3. Surface micro-hardness of experimental groups; Control: only denture base resin, Exp 1: 1 wt% experimental material, Exp 2: 2 wt% experimental material, Exp 3: 3 wt% experimental material
의치상용레진에 무기항균제를 포함한 시편의 친수성 변화를 확인하기 위하여 접촉각측정기로 측정한 결과, 대조군은 70.39±3.61, Exp 1 그룹은 70.48±4.52, Exp 2 그룹은 71.26±5.28, Exp 3 그룹은 71.53±2.68 나타났다. 대조군과 비교하여 실험군의 유의한 차이가 없었다(p>0.05)<Fig. 4>.
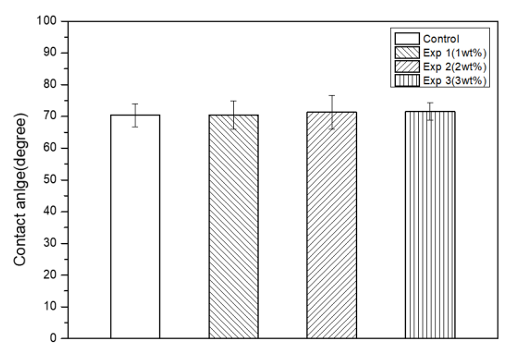
Fig. 4. Contact angle on denture base resin; Control: only denture base resin, Exp 1: 1 wt% experimental material, Exp 2: 2 wt% experimental material, Exp 3: 3 wt% experimental material
무기항균제를 포함한 의치상용레진의 C. albicans 균의 항균력을 CFU 값으로 확인한 결과, 대조군은 1×105를 나타냈으며, 1 wt% 그룹은 2,029.33±827.93, 2 wt% 그룹은 56.83±86.59, 3 wt%는 46.33±69.89 값을 나타내 유의한 차이가 있었다(p<0.05)<Fig. 5>.
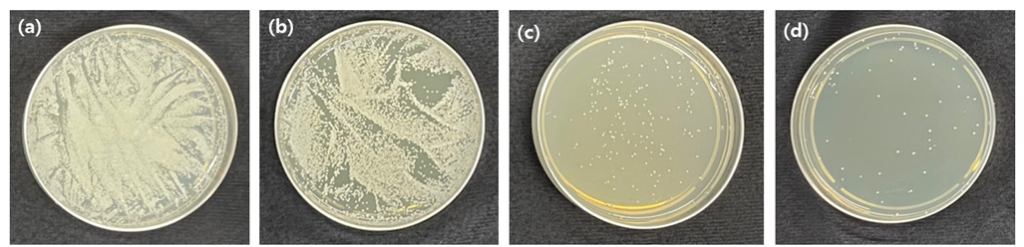
Fig. 5. CFU of experimental group; (a) Control group, (b) Inorganic antimicrobial material in specimens 1%, (c) Inorganic antimicrobial material in specimens 2%, (d) Inorganic antimicrobial material in specimens 3%.
의치상용레진의 항균력을 확인하기 위하여 C. albicans 균을 적용한 결과, 대조군은 0.92±0.03, Exp 1 그룹은 0.6±0.09, Exp 2 그룹은 0.62±0.1, Exp 3 그룹은 0.57±0.09로 나타났다. 대조군의 O.D값과 비교하여 무기항균제를 포함한 실험군의 C. albicans 생존률이 낮아졌으며 유의한 차이가 있었다(p<0.05)<Fig. 6>.
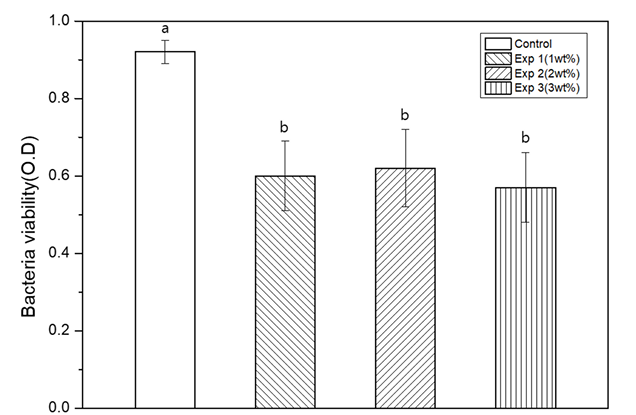
Fig. 6. Result of bacteria viability (Optical Density); Control: Only bacteria, Exp 1: Inorganic antimicrobial material in specimens 1%, Exp 2: Inorganic antimicrobial material in specimens 2%. Exp 3: Inorganic antimicrobial material in specimens 3%. Other lowercase letters indicate statistical differences between groups (p<0.05).
구강 내 의치는 장착 시 미생물 침착이 쉽고 감염의 위험성이 있다. 이에 항균력을 가지는 의치상용 레진이나 의치상용 레진의 미생물 부착을 막기 위한 여러 연구들이 진행되고 있다[18,19].
이러한 의치의 미생물 관리를 위하여 의치세정제나 클로르헥시딘과 같은 항균 소독제를 활용하여 치태 침착을 조절하고 의치상 표면 위의 미생물을 억제하고자 하였다. 그러나 클로르헥시딘은 의치의 변색 등의 문제를 일으켜 최근 유사한 항균 효능을 가지면서 더 안전한 세정제 및 소독제의 개발이 요구되며 연구되고 있다[20].
치과 재료 중 우수한 항균력이 있는 제품을 만들기 위해 은 이온함량을 조절한 기존연구에 의하면 항균력을 보이는 은 이온 함량은 0.2-5 wt%라고 추천되었으며 은 제올라이트를 적용하였을 때 최적의 항균력 범위를 보인 것으로 확인되었다[21–23].본 연구에서는 항균성을 가지는 의치상용 레진을 만들기 위해 실버 설파다이진을 1 wt%, 2 wt%, 3 wt%로 함유한 자가 중합형 의치상용레진을 제작하였다. 실버 설파다이진은 화상 상처에 항균력을 가지는 제품으로 주로 사용하고 있으며 낮은 독성과 부작용이 적다고 확인되어 최근 의약계에서 많이 활용 되고 있다[24]. 1%의 농도의 크림으로 화상 연고로 사용되며 그 외에도 다양한 은을 함유한 여러 가지 연구들이 진행되고 있다[25].
본 연구에서는 실버 설파다이진을 1 wt%, 2 wt%, 3 wt%로 농도별 제작하였으며 각각의 실험군별 물리적 성질 변화가 없고 항균력을 가지는 적정농도를 찾고자 하였다. 또한 실버 설파다이진의 함유 농도에 따른 의치상용 레진의 물리적 성질 변화 유무를 확인하기 위하여, 거칠기, 경도, 접촉각을 측정하였다.
매끄럽지 않은 의치상용 레진의 표면은 치태의 침착하기 쉬우며 세균과 진균의 온상이 되기 쉽다. 따라서 본 연구에서는 표면 거칠기 변화를 확인하고자 하였으며, 본 실험결과 대조군과 비교하여 실험군의 거칠기 변화를 확인 할 수 없었다. 기존 Oh와 Bae[26]의 연구에서는 의치상용레진에 무기항균제를 첨가하여 물성 및 기계적 강도의 증가가 보였으나 본 연구에서는 의치상용레진의 경도는 대조군과 비교하여 유의차가 없었다.
의치상용레진의 표면의 화학적 변화를 확인하기 위해 접촉각을 측정한 결과, 대조군과 비교하여 접촉각 변화를 나타내지 않아 화학적 물성변화는 없었던 것으로 확인할 수 있었다.
Nam 등[27]의 연구에 의하면 질산은과 나노 사이즈의 은 입자를 함유한 의치상 레진으로 실험한 결과 은 투여 농도가 증가함에 따라 항균효과가 높아졌다고 하였으며 은의 입자와 혼합 형태에 따른 차이는 없다고 하였다. 본 연구에서 의치상용레진에 실버 설파다이진을 농도별 첨가한 OD값 결과 대조군에 비교하여 실험군은 유의차 있는 항균력을 나타냈지만 실험그룹간의 유의차는 확인 할 수 없었다. 실버 설파다이진을 1-3 wt%의 농도별 CFU와 OD값을 종합하여 평가하였을 때 항균력을 가진 이상적인 실버 설파다이진의 농도는 2-3 wt%라고 확인되었다.
본 연구에서는 실버 설파다이진을 1-3 wt%의 농도별 의치상용레진에 첨가하여 물성 변화의 여부와 항균실험을 실시하였다. 대조군과 비교하여 실험군에서 물리적 변화는 나타나지 않았으며, 항균력을 확인할 수 있었다. 하지만 C. albicans 외 다른 미생물에 대해 항균실험을 하지 않은 점과 다양한 항균력 실험 및 세포독성을 확인하지 못한 점은 본 연구의 한계점이라고 할 수 있다. 추후 연구에서는 다른 종류의 미생물을 적용한 항균 실험 과 다양한 항균력 평가 실험 및 세포독성평가를 진행해 볼 것이 고려된다.
본 연구는 항균력을 가지고 있다고 알려진 실버 설파다이진을 사용하여 의치상용레진을 제작하고 항균력과 재료의 물성평가를 하고자하였다. 자가중합형 의치상용레진의 실버 설파다이진을 첨가한 시편을 제작하여 아래와 같은 결론을 확인할 수 있었다.
1. 실버 설파다이진이 함유된 의치상용레진은 대조군과 비교하여 실험군의 물리적 평가 결과, 표면 거칠기, 표면경도, 접촉각의 유의차를 확인할 수 없었다.
2. 실버 설파다이진이 함유된 의치상용레진의 C. albicans 균을 적용하여 항균력을 확인한 결과 의차상용 레진의 항균력을 확인 할 수 있었다.
Conceptualization: YR Choi, MK Kang; Data collection: YR Choi; Formal analysis: MK Kang; Writing-original draft: YR Choi, MK Kang; Writing-review&editing: YR Choi, MK Kang
The authors declared no conflicts of interest.
None.
None.
None.
이 논문은 2023년 한서대학교 교내연구과제 지원사업의 지원을 받아 수행된 연구임.
1. Kolenbrander PE. Oral microbial communities: biofilms, interactions, and genetic systems. Annu Rev Microbiol 2000;54(1):413-37. https://doi.org/10.1146/annurev.micro.54.1.413
[DOI][PubMed]
2. Korean Statistical Information Service. 2019 life tables for Korea [Internet]. Results of population projections; 2019. [cited 2023 Jan]. Available from: http://kosis.kr/statisticsList/statisticsListIndex.do?menuId=M_01_01&vwcd=MT_ZTITLE&parmTabId=M_01_01#SelectStatsBoxDiv.
3. Petersen PE, Yamamoto T. Improving the oral health of older people: the approach of the WHO Global Oral Health Programme. Community Dent Oral Epidemiol 2005;33(2):81-92. https://doi.org/10.1111/j.1600-0528.2004.00219.x
[DOI][PubMed]
4. Kandelman D, Petersen PE, Ueda H. Oral health, general health, and quality of life in older people. Spec Care Dentist 2008;28(6):224-36. https://doi.org/10.1111/j.1754-4505.2008.00045.x
[DOI][PubMed]
5. Campos MS, Marchini L, Bernardes LAS, Paulino LC, Nobrega FG. Biofilm microbial communities of denture stomatitis. Oral Microbiol Immunol 2008;23(5):419-24. https://doi.org/10.1111/j.1399-302X.2008.00445.x
[DOI][PubMed]
6. Muenz R. Aging and demographic change in European societies: main trends and alternative policy options (vol. 703). World Bank, Social Protection Advisory Service; 2007: 1-38.
7. O’Donnell LE, Robertson D, Nile CJ, Cross LJ, Riggio M, Sherriff A, et al. The oral microbiome of denture wearers is influenced by levels of natural dentition. PloS One 2015;10(9):e0137717. https://doi.org/10.1371/journal.pone.0137717
[DOI][PubMed][PMC]
8. Richa G, Reddy KM, Shastry YM, Aditya SV, Babu PJK. Effectiveness of denture cleansers on flexible denture base resins in the removal of stains colored by food colorant solution: an in vitro study. J Indian Prosthodont Soc 2022;22(3):288-93. https://doi.org/10.4103/jips.jips_480_21
[DOI][PubMed][PMC]
9. Pesci‐Bardon C, Fosse T, Madinier I, Serre D. In vitro new dialysis protocol to assay the antiseptic properties of a quaternary ammonium compound polymerized with denture acrylic resin. Lett Appl Microbiol 2004;39(3):226-31. https://doi.org/10.1111/j.1472-765X.2004.01569.x
[DOI][PubMed]
10. Kanie T, Arikawa H, Fujii K, Inoue K. Physical and mechanical properties of PMMA resins containing γ-methacryloxypropyltrimethoxysilane. J Oral Rehabil 2004;31(2):166-71. https://doi.org/10.1111/j.1365-2842.2004.01043.x
[DOI][PubMed]
11. Gong SQ, Epasinghe J, Rueggeberg FA, Niu LN, Mettenberg D, Yiu CK, et al. An ORMOSIL-containing orthodontic acrylic resin with concomitant improvements in antimicrobial and fracture toughness properties. PloS One 2012;7(8):e42355. https://doi.org/10.1371/journal.pone.0042355
[DOI][PubMed][PMC]
12. Mahamuni-Badiger PP, Patil PM, Badiger MV, Patel PR, Thorat-Gadgil BS, Pandit A, et al. Biofilm formation to inhibition: role of zinc oxide-based nanoparticles. Mater Sci Eng 2000;108:110319. https://doi.org/10.1016/j.msec.2019.110319
[DOI][PubMed]
13. Yoshida K, Tanagawa M, Atsuta M. Characterization and inhibitory effect of antibacterial dental resin composites incorporating silver-supported materials. J Biomed Mater Res 1999;47(4):516-22. https://doi.org/10.1002/(SICI)1097-4636(19991215)47:4<516::AID-JBM7>3.0.CO;2-E
[DOI]
14. Malic S, Rai S, Redfern J, Pritchett J, Liauw CM, Verran J, et al. Zeolite-embedded silver extends antimicrobial activity of dental acrylics. Colloids Surf B Biointerfaces 2019;173:52-7. https://doi.org/10.1016/j.colsurfb.2018.09.043
[DOI][PubMed]
15. Bedi RS, Cai R, O’Neill C, Beving DE, Foster S, Guthrie S, et al. Hydrophilic and antimicrobial Ag-exchanged zeolite a coatings: a year-long durability study and preliminary evidence for their general microbiocidal efficacy to bacteria, fungus and yeast. Microporous Mesoporous Mater 2012;151:352-7. https://doi.org/10.1016/j.micromeso.2011.10.012
[DOI]
16. Mohseni M, Shamloo A, Aghababaei Z, Vossoughi M, Moravvej H. Antimicrobial wound dressing containing silver sulfadiazine with high biocompatibility: in vitro study. Artif Organs 2016;40(8):765-73. https://doi.org/10.1111/aor.12682
[DOI][PubMed]
17. Jodar KS, Balcao VM, Chaud MV, Tubino M, Yoshida VM, Oliveira JJM, et al. Development and characterization of a hydrogel containing silver sulfadiazine for antimicrobial topical applications. J Pharm Sci 2015;104(7):2241-54. https://doi.org/10.1002/jps.24475
[DOI][PubMed]
18. Bajunaid SO, Baras BH, Weir MD, Xu HHK. Denture acrylic resin material with antibacterial and protein-repelling properties for the prevention of denture stomatitis. Polymers 2022;14(2):230. https://doi.org/10.3390/polym14020230
[DOI][PubMed][PMC]
19. An S, Evans JL, Hamlet S, Love RM. Incorporation of antimicrobial agents in denture base resin: a systematic review. J Prosthet Dent 2021;126(2):188-95. https://doi.org/10.1016/j.prosdent.2020.03.033
[DOI][PubMed]
20. Silva PMBD, Acosta EJTR, Jacobina M, Pinto LDR, Porto VC. Effect of repeated immersion solution cycles on the color stability of denture tooth acrylic resins. J Appl Oral Sci 2011;19(6):623-7. https://doi.org/10.1590/s1678-77572011000600013
[DOI][PubMed][PMC]
21. Yoshida K, Tanagawa M, Atsuta M. Characterization and inhibitory effect of antibacterial dental resin composites incorporating silver-supported materials. J Biomed Mater Res 1999;47(4):516-22. https://doi.org/10.1002/(SICI)1097-4636(19991215)47:4<516::AID-JBM7>3.0.CO;2-E
[DOI]
22. Lee JH, Lee SB, Kim KN, Kim KM, Lee YK. Antibacterial effect of silver-zeolites in glass-ionomer cements. Key Eng Mater 2007;330:831-4. https://doi.org/10.4028/www.scientific.net/KEM.330-332.831
[DOI]
23. Nam KY. Antimicrobial effect and cytotoxicity of experimental tissue conditioner containing silver nanoparticles. Kor J Dent Mater 2012;39(2):129-36. https://doi.org/10.14815/kjdm.2012.06.39.2.129
[DOI]
24. Hoffmann S. Silver sulfadiazine: an antibacterial agent for topical use in burns. A review of the literature. Scand J Plast Reconstr Surg 1984;18(1):119-26. https://doi.org/10.3109/02844318409057413
[DOI][PubMed]
25. Fuller FW, Parrish M, Nance FC. A review of the dosimetry of 1% silver sulfadiazine cream in burn wound treatment. J Burn Care Rehabil 1994;15(3):213-23. https://doi.org/10.1097/00004630-199405000-00003
[DOI][PubMed]
26. Oh SH, Bae JM. Effect of the silver-zeolite concentration and the storage period on the mechanical properties of denture base resins. Kor J Dent Mater 2008;35(3):265-71.
27. Nam KY, Lee CJ, Lee MS. Inhibitory effect of PMMA denture acrylic impregnated by silver nitrate and silver nano-particles for Candida albicans. J Korean Chem Soc 2008;52(4):380-6. https://doi.org/10.5012/jkcs.2008.52.4.380
[DOI]