Department of Dental Hygiene, Dongseo University
Correspondence to Kyung-Hee Lee, Department of Dental Hygiene, Dongseo University, 47 Jurye-ro, Sasang-gu, Busan-si, 47011, Korea. Tel: +82-51-320-2730, Fax: +82-51-320-2752, E-mail: kyhee@dongseo.ac.kr
Volume 25, Number 2, Pages 133-41, April 2025.
J Korean Soc Dent Hyg 2025;25(2):133-41. https://doi.org/10.13065/jksdh.2025.25.2.5
Received on January 17, 2025, Revised on February 13, 2025, Accepted on February 16, 2025, Published on April 30, 2025.
Copyright © 2025 Journal of Korean Society of Dental Hygiene.
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License(http://creativecommons.org/licenses/by-nc/4.0)
Objectives: This study aimed to evaluate the pain induced in the trigeminal ganglion (TG) by pulpitis and investigate the changes in inflammation-related signaling pathways within the TG. Additionally, the study compared pain intensity and inflammatory signaling changes after treatment with the antioxidant coenzyme Q10. Methods: An experimental model of acute pulpitis was created by treating the maxillary left first molar of 6-week-old C57BL/6 mice (20–25 g) with AITC. Neuronal activation in the TG was analyzed 3 days after treatment using optical imaging. Protein expression of inflammation-related molecules (TNFα, IL-6, c-Fos) and antioxidant-related pathways (Nrf2, SOD) was evaluated using western blot analysis. Results: In the TG, a significant increase in pain-related neuronal activity was observed in the pulpitis model, accompanied by an upregulation of the inflammatory cytokines TNFα and IL-6. Coenzyme Q10 treatment mitigated the heightened neuronal activity by altering membrane potentials. Additionally, Nrf2 and SOD expression significantly reduced following treatment with coenzyme Q10. These findings suggest that coenzyme Q10 modulates nociceptive signal processing in pulpitis-induced pain by influencing the inflammatory response through its antioxidant properties. Conclusions: Coenzyme Q10 is a potential therapeutic agent for alleviating pain and tissue damage associated with pulpitis through its antioxidant and anti-inflammatory effects.
Antioxidant, Coenzyme Q10, Inflammation, Pulpitis, Trigeminal ganglion
치수는 치아의 단단한 조직 내에 존재하고, 세균 및 여러가지 원인으로 손상을 입으면 치수 조직은 염증 반응을 일으키며 심각한 통증이 유발된다. 이는 치수 염증과 관련된 이질성과 지속성 및 통각 과민증을 나타내고 이러한 상태를 치수염이라고 한다[1]. 임상적 관점에서 치수염 통증 증상의 유무에 따라 비가역적인 것으로 판단되면 근관 치료 및 발치를 포함한 침습적 치료를 선택하게 된다. 하지만 감각 기능의 소실을 포함한 치수염의 조직 손상 정도와 통증의 강도에 따른 관계는 명확하지 않고, 치수염의 다양한 염증 매개체와 함께 프로스타글란딘 대사 산물은 말초 및 중추신경계의 통증과민성을 증가시켜 치수 통을 악화시킬 수 있다[2]. 이러한 치수염으로 인한 통증은 심각한 불편 감을 유발하고 환자의 삶의 질에도 영향을 미치지만, 치수염에 대한 치료 전략과 장기적인 효과도 상대적으로 제한적이다. 치아손상으로 인한 통증에 관여하는 삼차신경(Trigeminal ganglion, TG)은 대부분의 신경 염증과 통각 과민증이 관찰되며[3], 삼차신경절로 둘러싸인 신경 섬유에 의해 구강 부위의 감각이 주로 생성된다. 삼차신경절에는 치수의 일차 구심성신경세포체가 존재하고, 여러가지 자극이 치수 통각 수용체에 작용하여 삼차신경 감각 섬유의 다양한 수용체 또는 이온 채널을 활성화하고 삼차신경 뉴런을 활성화시켜 유해 정보를 대뇌피질에 전달한다[4]. 치수 염증은 자발적 통증과 이질통등 다양한 통증 증상을 유발하지만 그 메커니즘은 완전히 이해되지 않고 있다[5].
활성산소종(Reactive oxygen species, ROS)은 염증에 있어 중요한 역할을 하며, 치수염에서 활성산소종은 병원성 박테리아 제거를 위한 면역세포를 침투시켜 생성되지만 주변 조직을 손상 시킬 수 있고 더 나아가 치수세포도 활성산소종을 생성한다[6]. 이러한 초기 치수 내 활성산소 신호의 차단은 염증 관련 조직 손상을 예방하기 위한 치료의 표적이 될 수 있다. 활성산소종을 제거하는 항산화제로 잘 알려진 코엔자임 Q10은 물에 녹지 않는 벤조피렌 고리 구조에 이소프렌 가지 구조를 가진 화합물로 미토콘드리아의 전자전달계에서 에너지 생성과 결합 저지단백질의 중요한 성분으로 미토콘드리아 기능 유지에 필수요소로 잘 알려져 있다. 코엔자임 Q10은 유비퀴논으로 전자전달계에서 2개의 전자를 받아 운반하는 역할을 하며 체내에서 산화물에 전자를 제공하는 항산화제의 역할을 동시에 수행한다. 또한, 코엔자임 Q10은 다른 항산화 물질의 재생과 자극, 세포 성장 및 세포 사멸 억제에도 관여하며, 체내에서 합성이 된다[7]. 하지만, 나이가 들거나 만성질환이 있는 경우 체내 합성 능력이 저하되어 코엔자임 Q10이 충분하게 합성 및 생성되지 못하게 되어 감소된다[8]. 즉 이는 심장, 면역과 같이 신진대사가 활발한 조직뿐만 아니라, 치은 및 위 점막과 같은 대사 활동이 이루어지는 조직에서도 기능 장애를 유발한다[9]. 코엔자임 Q10는 내인성 항산화제로 작용하여 염증이 있는 치은에서 코엔자임 Q10의 농도가 높아져 진행성 치주 염증을 효과적으로 억제할 수 있으나, 치은 조직에서 코엔자임 Q10의 감소는 치주질환으로 이어질 수 있다[10]. 즉, 정상적인 생물학적 과정에서 자유 라디칼과 활성산소종은 매우 중요하지만, 항산화 수준이 충분하지 않으면 치주 조직이 산화 스트레스에 대처할 수 없어 치주 조직 손상의 심각성이 증가한다[11]. 즉, 코엔자임 Q10 결핍은 치주질환과 관련이 있으며, 코엔자임 Q10을 치주 조직에 투여할 경우 활성산소의 생성을 억제하여 진행성 치주염을 조절한다는 보고가 있다 [12]. 특히, 치주질환을 겪고 있는 당뇨병 환자에 코엔자임 Q10 보충제를 처방하면 치주질환이 개선된다는 보고도 있다[13]. 치은염 및 경증에서 중등도 치주염 환자 치료에 글리세린과 코엔자임 Q10을 혼합한 페리오큐를 국소 도포 시 치주염 완화 효과에 대한 임상적 연구들이 활발하게 이루어지고 있다[14,15]. 하지만, 임상전단계인 연구 영역에서 이와 관련된 연구는 미미하며 과학적 근거에 대한 뒷받침이 필요한 실정이다.
이에 본 연구의 구체적인 연구 목적은 다음과 같다.
첫째, 치수 염증 유발에 따른 삼차신경절의 통증 유발 정도를 확인하고자 한다.
둘째, 치수 염증 유발에 따른 삼차신경절의 염증 관련 신호전달 기전의 변화를 확인하고자 한다.
셋째, 치수 염증 모델에 항산화제인 코엔자임 Q10을 처리 후 통증 및 염증 관련 신호전달 물질 변화 정도를 비교 관찰하고자 한다.
모든 실험은 C57BL/6 마우스 7주령(80-100 g, Koatech, Pyeongtaek, Korea)을 사용하였으며, 총 21마리를 사용하였다(전기생리학적 실험 12마리, 전기영동 실험 9마리, 각 그룹당 n=3). 본 연구는 연세대학교 의과대학 동물실험윤리위원회(IACUC 승인번호: 2021-0173)의 승인을 받아 실시하였다. 실험용 마우스는 12시간 주기로 명암이 바뀌는 사육 환경에서 사육되었으며, 사료와 물은 자유롭게 제공되었다. 실험 동물은 펜토바비탈 나트륨(Pentobarbital, 75 mg/kg)을 복강 내 주입하여 마취하고, 각 실험에 사용하였다.
저속 치과용 드릴을 사용하여 마우스의 왼쪽 상악 제1대구치(M1)의 치수를 노출시키고, 노출된 치수에 AITC (Sigma-Aldrich, Milwaukee, WI, US)에 담근 치과용 페이퍼 포인트(Dental paper point; 직경 0.15 mm, 길이 20 mm)를 1분간 도포하여 치수 염증을 유발하였다.
실험군은 각 AITC 도포 후 Coenzyme Q10 (0.1 mg/ml, Sigma-Aldrich)에 담근 페이퍼 포인트를 3분간 도포한 그룹과 AITC 도포 후 생리식염수에 담근 페이퍼 포인트를 3분간 도포한 그룹으로 나누어 비교하였다. 노출된 M1의 치수는 레진으로 수복하여 각 실험 모델로 사용하였다. 즉, 치수 염증 유발 후 코엔자임 Q10을 처리한 실험군(Pulpitis+CoQ10 군; n=3), 염증 유도 후 식염수를 도포한 치수염 실험군(Pulpitis 군; n=3)나누어 진행되었으며, 모든 실험은 실험동물 사용을 최소화하기 위해 수행되었습니다. 대조군(Normal 군; n=3)은 치수만을 노출시키고 염증을 유도하는 AITC 대신 식염수만을 사용하였다.
전기생리학적 기법을 이용한 통증 유발 억제 정도를 확인하기 위해 치수염 유도 3일 후 펜토바비탈 나트륨(75 mg/kg)을 사용하여 마우스를 마취하고, 대뇌를 제거하고 삼차 신경을 적출하여 5% CO2를 포함한 인공 뇌척수액(Artificial cerebrospinal solution, ACSF)로 온도 37℃, 1시간 안정화 과정을 거쳐 이후 실험을 진행하였다. 친수성 신경막 전위차 염색제(Voltage sensitive dye, VSD)인 Di-2-ANEPEQ (50 mg/ml, Molecular Probes, Eugene, OR, USA)로 1시간 염색 후 인공 뇌척수액으로 세척 후 유지하였다. 삼차 신경 자극을 위한 전극으로 Bipolar electrode를 사용하여 전기 자극(200 ms 지연, 1 ms 펄스, 3초 자극 간 간격, 0.1-1 mA 강도)을 하였다. 활성화된 영역과 진폭은 0.5 mA의 전기 자극에서 각 실험군들을 비교 분석하였다. 고해상도 CCD 카메라의 축은 삼차신경절의 표면에 수직으로 위치시키고 이미지 필드에 V3를 표시하였다. 신경막 전위차 염색제의 형광 변화는 고해상도 CCD 카메라(최대 프레임당 3.7 ms)로 구성된 MiCAM02 시스템(BrainVision, Tokyo, Japan)을 사용하여 신경세포 활성을 시각화 하여 나타내며, 이러한 광학 이미징 기법은 일반적으로 10회의 획득 영상을 자극/비자극 감산 방법을 사용하고 심전도에 의해 노이즈가 제거된 영상을 평균화하여 신경 활성 변화 반응을 확인하였다. 광영상 이미지 획득은 전기 자극에 의해 나타나며, 배율은 1×대물렌즈와 0.63×프로젝션 렌즈(Leica Microsystems Ltd., Wetzlar, Germany)로 192×128 픽셀의 Detector array를 생성하였다. 각 빨간색과 초록색의 컬러 이미지에 대해 활성화 영역을 분석하고, 캡처 된 각 이미지의 변환된 영역을 백분율(활성화 영역/전체 캡처 영역×100)로 평가하였다. 광도 및 활성화 영역은 MetaMorph software (Universal Imaging Co., PA, USA)를 사용하여 비교 분석하였다.
각 그룹에서 표적 삼차신경절을 채취하여 액체 질소에 즉시 냉동시켜 phosphatase and protease inhibitors (PhosSTOP; Roche, Mannheim, Germany)가 첨가된 lysis buffer (PRO-PREP; Intron Biotechnology, Pyeongtaek, Korea)를 이용하여 단백질을 분리하였다. 분리된 단백질은 4℃, 13,000×g로 15분간 원심분리하여 상층액을 분리하고, 단백질을 SDS-PAGE로 분리하였다. 분리된 단백질은 PVDF membrane (Merck Millipore, Darmstadt, Germany)으로 옮겨 5% bovine serum albumin 용액에 실온에서 1시간 동안 처리하였다. Anti- TNFα (1:1,000; Abcam, Cambridge, United Kingdom), anti- IL6 (1:1000; Cell Signaling Technology, Danvers, MA, United States), anticFos (1:1000; Cell Signaling), anti-Nrf2 (1:5000; Abcam), anti-SOD (1:2000; Abcam) 및 β-actin 항체(1:10,000; Cell Signaling)를 4℃에서 overnight 하였다. 이후 Membrane은 horse radish peroxidase가 부착된 이차 항체 anti-rabbit IgG (1:10,000; Cell Signaling)를 2시간, 20℃에서 반응시켰다. 반응시킨 membrane은 chemiluminescent detection system인 ECL plus kit (GE Healthcare, Little Chalfont, United Kingdom)로 발색 하여 특정 단백질을 LAS 시스템(LAS 4000; GE Healthcare)을 이용하여 분석하였다.
모든 실험 데이터들은 mean±SEM으로 표현하였으며, 광영상 이미지 데이터에서 두 집단 간의 차이는 t-test를 통해 비교 및 분석하였다. 또한, 단백질 분석 데이터에서 그룹 간 비교는 Kruskal-Wallis 검정을 수행한 후 사후 검정으로 Mann-Whitney U 검정을 사용하여 분석하였으며, 통계 분석 프로그램은 IBM SPSS program (ver. 23.0; IBM Corp., Armonk, NY, USA)를 사용하여 α=0.05로 설정하여 통계적으로 유의미한 것으로 판정하였다.
치수염 통증 정도를 관찰하기 위해 신경막 전위차 염색제를 이용한 광영상법으로 세포막 전위 변화에 따른 신경세포 활동을 관찰하였으며, 상악 왼쪽 대구치 치수로부터 올라가는 삼차신경절 자극에 따른 삼차신경세포 활성화를 광영상기법을 이용하여 공간적, 시간적 변화 정도를 비교 및 분석하였다. 광영상 이미지는 치수염을 유발하지 않은 대조군에서 전기 자극에 대한 신경세포 활성이 자극 부위에 한정되어 나타나는 현상을 보였나, 치수염 그룹에서는 1 mA 전기 자극에 의한 삼차신경의 활성화가 더 빠르고 크게 주변으로 퍼져 나가는 대표적인 통증 유발 정도를 나타내었다. 대조군과 비교 시 치수염 통증에서 더 넓고 높은 패턴의 삼차신경세포 활성화 영역이 관찰되었다<Fig. 1A>. 붉은 색부터 초록색까지 나타나는 활성화정도의 변화를 확인하고 가장 활성화된 붉은색이 변한 픽셀의 활성화 면적을 측정하여 분석한 결과<Fig. 1B>, 대조군에서는 1 mA 전기 자극에 대한 가장 활성화된 신경막 전위차 변화는 3.12±0.09로 나타났다. 하지만, 치수염 그룹에서는 신경세포 활성이 166.34±11.62로 통계학적으로 유의미하게 대조군에 비해 증가하였다(p<0.01). 또한, 초록색 영역에서는 대조군은 207.10±35.30 이었으나 치수염 그룹에서는 641.33±56.20으로 유의미하게 증가된 양상을 보였다(p<0.01). 치수염 통증 반응 속도에 있어서 치수염 그룹에서는 0.56±0.03 이며, 대조군에서는 0.28±0.04로 확인되어 치수염일 경우 신경세포는 더 빠르게 통증을 전달하는 것으로 관찰되었다(p<0.01) <Fig. 1C>.

Fig. 1. Comparison of normal sham and pulpitis model. More activated pixels and higher peak activity were observed in AITC-treated pulpitis group. Representative image of the activated areas shown in green/red in Normal and pulpitis group (A). Data are presented as mean±SEM (B). Max peaked values after stimulation were analyzed (C). **p<0.01, *p<0.05, t-test. n=3 per group.
광영상 이미지 결과 치수염 그룹에서 전기 자극에 대한 신경세포 활성이 강하고 크게 주변으로 퍼져 나가는 통증 유발 정도를 나타내었다. 반면, 코엔자임 Q10 그룹에서는 과 흥분성 신경세포의 활동을 20-40%까지 억제하는 패턴의 삼차신경세포 활성화 부위가 감소하는 영역이 관찰되었다<Fig. 2A>. 항산화제인 코엔자임 Q10 처리 시 신경세포의 전기 자극에 따라 나타나는 활성화 패턴을 광영상 이미지의 픽셀로 분석한 결과, 치수염 및 코엔자임 Q10 그룹의 빨간색과 녹색 픽셀을 비교했을 때 유의미한 차이를 보였다(빨간색: 치수염 163.41±10.37, 코엔자임 Q10 45.00±9.16, 녹색: 치수염 630.41±55.21, 코엔자임 Q10 439.67±58.15) <Fig. 2B>. 코엔자임 Q10을 치수염 유발 후 처리한 그룹에서 활성화 신경세포의 반응 속도가 현저히 감소하는 것을 확인하였다(치수염: 0.56±0.03, 코엔자임 Q10: 0.39±0.05) (p<0.05)<Fig. 2C>.
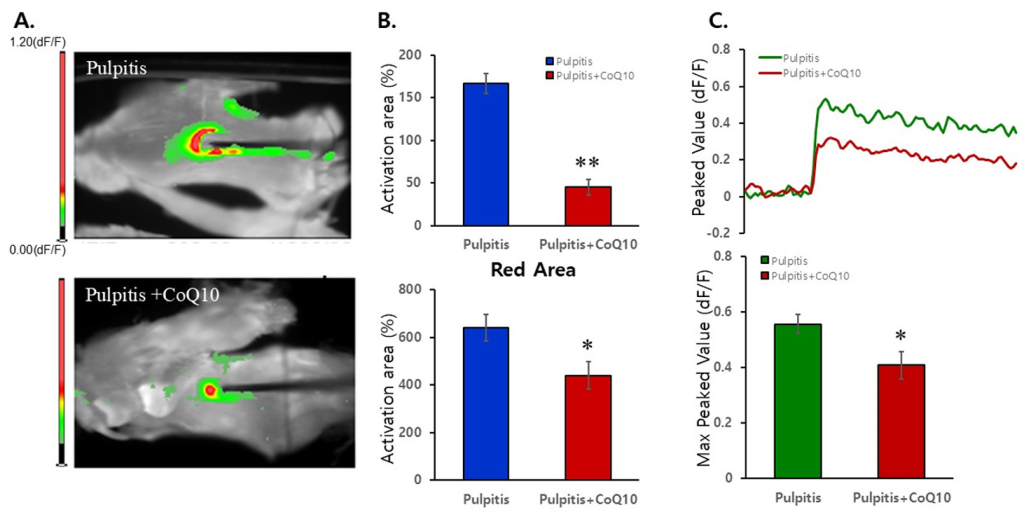
Fig. 2. Comparison of pulpitis and pulpitis+CoQ10 model. Reduced neuronal activities in TG by application of the CoQ10 treatment. Representative image of the activated areas shown in green/red (A) Data are presented as mean±SEM (B) Max peaked values after stimulation were analyzed (C) **p<0.01, *p<0.05, t-test. n=3 per group.
AITC 처리에 따른 치수염 유발에 의해 활성화된 신호전달 기전의 단백질 발현량 변화를 평가하기 위해 분자생물학적 기법인 전기영동법을 사용하여 치수부터 대뇌로 올라가는 삼차신경절에서 통증 신호의 단백질 활성화정도를 확인하였다. 본 연구에서는 염증관련 인자인 TNF-α, IL6, c-Fos 단백질과 항산화 활성화 인자인 Nrf2와 SOD 단백질을 대조군과 각 실험그룹에서 단백질 발현 수준을 비교 및 분석하였다<Fig. 3>. 삼차신경절에서 염증 사이토카인 중 하나인 TNF-α발현 수준은 대조군(0.92±0.06)에 비해서 치수염 그룹(1.71±0.20)에서 유의미하게 증가하는 양상을 보였으나, 항산화제인 코엔자임 Q10을 처리한 그룹(1.20±0.14)에서 TNF-α 단백질 발현량이 유의미하게 감소하였다(p<0.05)<Fig. 3A>. 또다른 발열 및 급성 염증 반응에 중요한 매개체로써 알려진 IL6 사이토카인에서도 유사한 단백질 발현 양상을 보여 대조군 0.86±0.07, 치수염 그룹 1.19±0.07, 코엔자임 Q10 그룹 0.93±0.06로 염증성 사이토카인 생성을 유발하는 세포내 신호 전달 단백질 발현에 유의미한 차이를 보였다(p<0.05)<Fig. 3B>. 하지만, 신경세포에서 통증관련 인자로 알려진 c-Fos 단백질 발현에 있어 대조군에 비해 치수염 그룹에서 증가하는 양상을 보였으나 코엔자임 Q10 그룹과 유의미한 차이를 보이지 않았다(대조군 1.05±0.12; 치수염 1.51±0.20; 코엔자임 Q10 1.29±0.20)<Fig. 3C>. 염증에 의한 산화적 손상으로부터 보호하는 항산화 단백질로 알려진 Nrf2 단백질 발현은 치수염 그룹(0.97±0.08)에서 대조군(1.51±0.11)과 코엔자임 Q10 그룹(1.33±0.10)에 비해 유의미하게 감소됨을 확인하였다(p<0.05)<Fig. 3D>. 또한, 신경세포의 중요한 항산화 효소로 알려진 SOD의 발현은 치수염 그룹이 대조군에 비해 삼차신경절 부위에서 유의미하게 감소된 반면, 코엔자임 Q10 처리 그룹은 유의하게 발현이 활성화된 것으로 관찰되었다(대조군 1.27±0.13; 치수염 0.66±0.06; 코엔자임 Q10 그룹 1.09±0.14) (p<0.05)<Fig. 3E>. 치수염 그룹에서는 대조군에 비해 삼차신경절에서 TNF-α, IL6 및 c-Fos의 발현 수준이 유의하게 증가하였다. 항산화제인 코엔자임 Q10 처리 그룹에서는 Nrf2와 SOD 단백질 발현량이 유의미하게 증가함을 확인하였다.
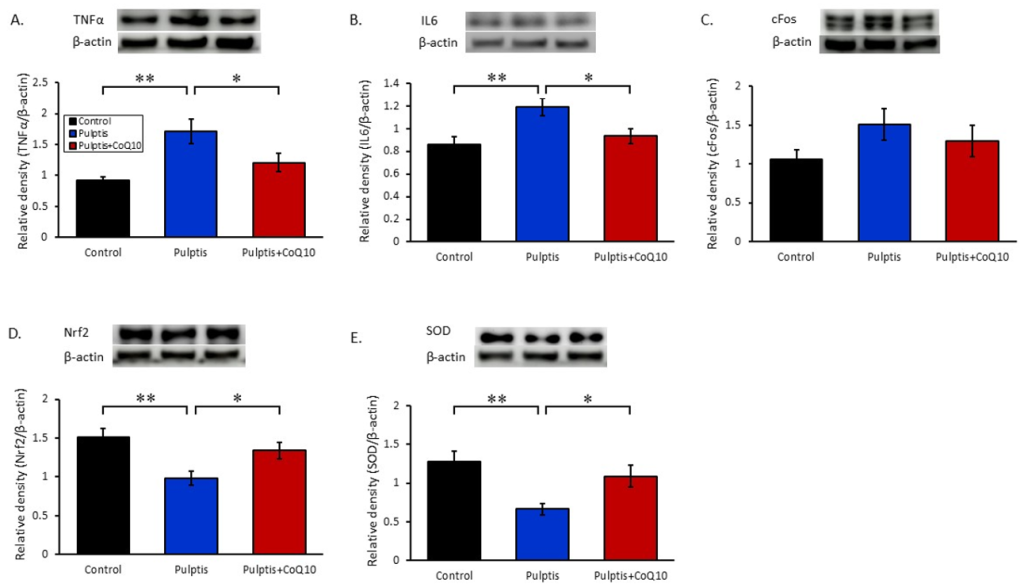
Fig. 3. Changes in the relative density of inflammatory signals (TNFα, IL6, c-Fos) and antioxidant signals (Nrf2, SOD protein in Trigeminal ganglion. Protein levels were statistically different between pulpitis and pulpitis +CoQ10 treatment. The band densities from three independent experiments were quantified and plotted as relative intensities (means±SEM). KruskalWallis and Mann–Whitney nonparametric tests were used for statistical analysis. Asterisks indicate significant differences compared with the pulpitis group (*p<0.05).
본 연구는 염증 반응과 관련된 구강 안면 통증 양상을 생체 내 전기생리학적 기록을 통해 확인한 이전 연구[16]의 치수염 통증 모델에서 염증성 반응을 조절하는 항산화제인 코엔자임 Q10 역할을 규명하고자 하였다. 연구 결과, 치수 염증에 따른 삼차신경절의 과 흥분성 신경세포 활성은 항산화제인 코엔자임 Q10 처리에 따른 막전위 변화에 의해 신경세포 흥분성 증가를 억제하는 것으로 관찰되었다. 또한, 코엔자임 Q10 처리 후 통증 관련 분자생물학적 신호전달 물질의 수준이 현저히 감소하였다. 따라서 코엔자임 Q10은 항산화제로써 염증성 반응을 조절하여 치수염으로 인한 통증의 통각 신호 처리를 조절할 수 있을 것으로 생각된다.
광영상 이미징 데이터는 시냅스 후 뉴런세포의 집단 활동에서 발생하는 전기 신호를 활성화된 영역으로 자극 유발 활동의 분포 지도로 시각화한 기법이다[17]. 본 연구에서는 이러한 신경세포의 흥분성 활성화와 반응 속도 및 크기를 평가하기 위해 신경막 전위차 염색제의 광영상 이미징을 사용하여 삼차신경절의 전기 자극에 대한 신경세포 반응 변화와 강도를 관찰하였다. 치수염 모델에서 대조군에 비해 삼차신경절 자극 후 신경세포의 활성화 속도가 빨라지고 활성화 영역이 광범위해져 강도가 더 높은 것으로 관찰되었다. 이는 치수염은 세포내 나트륨채널의 막 흥분성을 증가시키고 삼차신경절에서 염증성 통증에 관여하는 Voltage-gated sodium channel을 증가시켜 신경세포의 활성화를 증가시켜 광영상 이미지에서 신경세포의 과 흥분성과 신경세포 활동이 증가된다는 이전 연구와 일치함을 보였다[16]. 최근 연구에 의하면 치주인대 세포에 AITC처리 후 빠른 Ca2+ 농도 증가가 일어나고 이는 TRP채널 중 TRPA1과 관련 있다는 결과와 일치한다[18]. 이는 치수뿐만 아니라 삼차신경섬유와 비 신경성 치수세포에 Transient receptor potential (TRP) 이온 채널이 관찰되며, 삼차신경 내 TRP채널은 다양한 형태의 구강안면 통증과 관련이 있고 비신경 치수 세포에 의해 발현되는 TRP채널이 염증신호 전달에 관여하여 치수염의 증상에 관여한다[19]. 치수염의 발생은 일차적인 침입한 병원성 미생물과 관련된 병원체 분자 패턴과 손상 및 염증 조직에서 방출되는 손상 관련 패턴이 발병 원인이 되며, 이는 치수세포에서 이러한 분자 및 손상 관련 패턴을 Toll-like receptors (TLRs)를 활성화 시켜 염증 신호가 시작되어 염증성 사이토카인의 방출, 반응성 활성산소종의 생성 및 염증성 면역세포의 침입을 통해 심각한 결과를 초래한다[20]. 통증과 관련된 TRPA1 채널은 활성산소종에 의해서 활성화되며, 이는 과산화수소(H2 O2 )를 치아미백에 사용시 치수세포를 손상시키고 TRPA1 채널 발현을 유도하고 치아수복물로 사용되는 2-hydroxyethyl methacrylate를 치주인대세포주에 처리 시 활성산소종을 통한 TRPA1 채널을 활성화 한다는 연구에 의해 확인되었다[21]. 코엔자임 Q10은 항산화제로써 작용하며 신경세포의 염증성 반응을 줄여줌으로써 세포의 염증성 통증 관련 과 흥분성 신호전달 물질 억제하는 작용을 한다. 즉, 본 연구의 광영상 이미지 결과 치수에 AITC처리 후 염증을 유발한 모델에 항산화제인 코엔자임 Q10 처리 시 치수염군에 비해 전기 자극에 대한 삼차신경세포의 활성화 속도가 감소되고 활성화 영역이 줄어들어 강도가 낮아지는 결과와 일치한다.
치수염 모델에서 다양한 신호전달 물질들은 치수의 염증 반응에 중심적인 역할을 한다. 본 연구의 분자생물학적 연구결과 염증성 사이토카인으로 알려진 TNF-a 및 IL6가 치수염군에서 증가된 반면 코엔자임 Q10 처리에 의해 감소되는 양상을 확인하였다. 이는 TNF-a 및 IL6 같은 염증 매개 물질은 염증 환경 내에서 통증 지각과 신경성 염증 반응을 통해 통각 신경 종말을 민감하게 만들 수 있다는 연구 결과와 일치한다[22]. 이러한 염증성 사이토카인은 치수세포 내 활성산소종의 증가를 유도하고 산화적 손상에 따른 세포사멸을 일으킨다[23]. 본 연구에서는 코엔자임 Q10 처리 시 항산화 작용에 관한 SOD와 Nrf2 신호전달 단백질의 유의미한 증가를 관찰하여 산화적 손상에 대해 과 분비된 활성산소종이 코엔자임 Q10에 의해 제거됨을 확인하였다. 이는 치주염 모델에서 코엔자임 Q10 처리 시 호중구와 림프구의 수가 줄어들어 염증 부위가 대조군에 비해 감소하고 빠른 회복력을 보인 이전 연구와 유사함을 보인다[24]. 또한, 쥐를 대상으로 한 생체 내 연구에서 발치 후 코엔자임 Q10 연고를 바르면 콜라겐 밀도가 증가하고 염증이 억제되었으며, 코엔자임 Q10을 치은에 국소 투여 시 GCF 흐름 및 치은낭의 깊이를 감소시키고 임상적 치은 부착을 개선한다는 이전 연구와 유사함을 보인다[25]. 즉, 이는 활성산소종에 의한 치수염 통증을 항산화제 처리에 따른 산화작용억제와 염증신호전달에 의한 염증성 반응을 낮추어 줌으로써 통증의 정도가 낮아졌다고 생각되며 코엔자임 Q10에 의해 조절되는 신경세포 흥분성은 염증성 치수염 통증의 병태생리학에 기여할 수 있을 것으로 생각된다. 본 연구의 제한점은 치수염 모델을 이용하여 코엔자임 Q10의 항산화 효과를 분석하였으나, 동물 모델의 한계로 인해 인간 치수염과의 직접적인 생리학적 비교가 어렵고, 장기적인 치료 효과 및 최적 투여 방식에 관한 추가 연구가 필요하다. 향후 연구에서 다양한 항산화제와의 비교, 치수염의 복합적인 면역반응을 고려한 다각적인 연구 및 장기적인 안전성 평가를 통해 임상 적용 가능성을 구체화할 필요가 있다.
본 연구는 치수 내 염증성 반응과 항산화제인 코엔자임 Q10 처리에 따른 구강악안면 통증 양상을 전기생리학 및 분자생물학적 기법을 통해 관찰함으로써 항산화제의 치수염 반응 신호전달 물질의 변화와 통증의 통각 신호처리 조절을 위한 역할을 확인함으로써 임상적 진료 시 치수염의 통증 관련 응용 가능한 기초자료를 제공하고자 하였으며, 다음과 같은 결론을 얻었다.
1. 전기생리학적 광영상 이미지 데이터의 활성화 영역을 색상 픽셀로 분석한 결과 대조군에서는 전기 자극에 대한 가장 활성화된 신경막 전위차 변화는 빨간색(3.12±0.09)과 초록색(207.10±35.30)의 색상 픽셀이 나타났지만, 치수염 그룹에서는 빨간색은 166.34±11.62로 초록색 영역에서는 641.33±56.20으로 통계학적으로 유의미하게 신경세포 활성이 증가된 양상을 보였다(p<0.01).
2. 치수염 통증 반응 속도에 있어서 치수염 그룹에서는 0.56±0.03이며 대조군에서는 0.28±0.04로 확인되어 치수염에서는 삼차신경절에서 더 빠르고 강한 활성화 반응이 관찰되었다(p<0.05).
3. 치수염 및 코엔자임 Q10 그룹에서 활성화 색상 픽셀인 빨간색과 녹색을 비교했을 때 유의미한 차이를 보였다(빨간색: 치수염 163.41±10.37, 코엔자임 Q10 45.00±9.16, 녹색: 치수염 630.41±55.21, 코엔자임 Q10 439.67±58.15)(p<0.05).
4. 코엔자임 Q10을 처리한 그룹에서 활성화된 신경세포의 반응 속도가 치수염 그룹은 0.56±0.03이고 코엔자임 Q10에서는 0.39±0.05로 현저히 감소하였다(p<0.05). 즉, 항산화제인 코엔자임 Q10은 염증에 의한 과 흥분성 신경세포의 활동을 20-40%까지 억제하였다.
5. 분자생물학적 기법을 이용한 삼차신경절의 신호전달 단백질 변화 정도를 관찰한 결과 치수염 그룹에서는 대조군에 비해 TNF-α와 IL6의 염증성 단백질 발현 수준이 유의하게 증가하였나(p<0.01), 아급성 염증단백질인 c-Fos에서는 증가하는 양상만이 관찰되었다. 항산화제인 코엔자임Q10 처리 그룹에서는 염증성단백질의 발현이 유의미하게 줄어들었으며(p<0.05), 활성산소종에 의한 산화적 손상을 감소시키는 NRF2와 SOD 단백질 발현량이 유의미하게 증가함을 확인하였다(p<0.05).
이상의 결과로 삼차신경절에서 치수염에 의한 통증관련 신경세포의 활성이 증가하였으며 염증성 사이토카인의 발현도 현저하게 증가하였다. 반면, 코엔자임 Q10의 처리에 따른 신경세포의 통증 관련 활성화는 감소하였으며 이와 관련된 항산화단백질의 발현량이 증가함이 관찰되었다. 이러한 결과는 코엔자임 Q10의 처리가 염증과 산화 스트레스로 인한 치수 손상 및 통증을 줄이는데 유용한 치료접근법을 제공할 수 있음을 시사한다.
The author fully participated in the work performed and documented truthfully.
KH Lee has been a member of editorial committee of the Journal of Korean Society of Dental Hygiene. She is not involved in the review process of this manuscript. Otherwise, there was no conflicts of interest.
This study was supported by Dongseo University, ‘Dongseo Frontier Project’ research fund of 2024.
These experiments were approved by the Institutional Animal Care and Use Committee (IACUC approval No. 2021-0173) in the Laboratory Animal Facility at Yonsei University (Seoul, Korea).
Data can be obtained from the corresponding author.
None.
1. Levin LG, Law AS, Holland G, Abbott PV, Roda RS. Identify and define all diagnostic terms for pulpal health and disease states. J Endod 2009;35(12):1645-57. https://doi.org/10.1016/j.joen.2009.09.032
[DOI] [PubMed]
2. Khalighinejad N, Aminoshariae MR, Aminoshariae A, Kulild JC, Mickel A, Fouad AF. Association between systemic diseases and apical periodontitis. J Endod 2016;42(10):1427-34. https://doi.org/10.1016/j.joen.2016.07.007
[DOI] [PubMed]
3. Byers MR, Narhi MV. Dental injury models: experimental tools for understanding neuroinflammatory interactions and polymodal nociceptor functions. Crit Rev Oral Biol & Med 1999;10(1):4-39. https://doi.org/10.1177/10454411990100010101
[DOI] [PubMed]
4. Emrick JJ, Von Buchholtz LJ, Ryba NJP. Transcriptomic classification of neurons innervating teeth. J Dent Res 2020;99(13):1478-85. https://doi.org/10.1177/0022034520941837
[DOI] [PubMed] [PMC]
5. Chen Y, Hu J, Qi F, Kang Y, Zhang T, Wang L. Acute pulpitis promotes purinergic signaling to induce pain in rats via P38MAPK/NF-κB signaling pathway. Mol Pain 2024;20:17448069241234451. https://doi.org/10.1177/17448069241234451
[DOI] [PubMed] [PMC]
6. Shirawachi S, Takeda K, Naruse T, Takahasi Y, Nakanishi J, Shindo S, et al. Oxidative stress impairs the calcification ability of human dental pulp cells. BMC Oral Health 2022;22(1):437. https://doi.org/10.1186/s12903-022-02467-w
[DOI] [PubMed] [PMC]
7. Hans M, Prakash S, Gupta S. Clinical evaluation of topical application of perio-Q gel (Coenzyme Q10) in chronic periodontitis patients. J Indian Soc Periodontol 2012;16(2):193-9. https://doi.org/10.4103/0972-124X.99261
[DOI] [PubMed] [PMC]
8. Geçer RB, Zengin ÖS, Karip BZ, Boran T, Çikler E, Özhan G, et al. Effects of coenzyme Q10 on orthodontic tooth movement and alveolar bone remodeling in rats. Clin Oral Investig 2024;28(9):486. https://doi.org/10.1007/s00784-024-05881-2
[DOI] [PubMed]
9. Soni S, Agrawal P, Sharma N, Chander S. Coenzyme Q10 and periodontal health: a review. Int J Oral Maxillofac Pathol 2012;3(2):21-6.
10. Iwamoto Y, Nakamura R, Folkers K, Morrison RF. Study of periodontal disease and coenzyme Q. Res Commun Chem Pathol Pharmacol 1975;11(2):265-71.
11. Herawati D. In vitro evaluation of coenzyme Q10 on primary fibroblast culture. Majalah Kedokteran Gigi Indonesia 2023;9(1):1-6. https://doi.org/10.22146/majkedgiind.80158
[DOI]
12. Manthena S, Rao MVR, Penubolu LP, Putcha M, Harsha AVNS. Effectiveness of CoQ10 oral supplements as an adjunct to scaling and root planing in improving periodontal health. J Clin Diagn Res 2015;9(8):ZC26-8. https://doi.org/10.7860/JCDR/2015/13486.6291
[DOI] [PubMed] [PMC]
13. Hanioka T, Tanaka M, Ojima M, Shizukuishi S, Folkers K. Effect of topical application of coenzyme Q10 on adult periodontitis. Mol Aspects Med 1994;15(S1):S241-S8. https://doi.org/10.1016/0098-2997(94)90034-5
[DOI] [PubMed]
14. Pitale U, Khetarpal S, Peter K, Pal V, Verma E, Gupta P. Evaluation of efficacy of coenzyme Q10 in management of gingivitis & slight periodontitis-a clinical study. Int J Curr Pharm Res 2012;4(4):33-8.
15. Sharma V, Gupta R, Dahiya P, Kumar M. Comparative evaluation of coenzyme Q10-based gel and 0.8% hyaluronic acid gel in treatment of chronic periodontitis. J Indian Soc Periodontol 2016;20(4):374-80. https://doi.org/10.4103/0972-124X.183097
[DOI] [PubMed] [PMC]
16. Lee KH. Pulpitis pain relief by modulating sodium channels in trigeminal ganglia. J Korean Soc Dent Hyg 2024;24(3):219-27. https://doi.org/10.13065/jksdh.20240303
[DOI]
17. Weisenburger S, Vaziri A. A guide to emerging technologies for large-scale and whole-brain optical imaging of neuronal activity. Annu Rev Neurosci 2018;41(1):431-52. https://doi.org/10.1146/annurev-neuro-072116-031458
[DOI] [PubMed] [PMC]
18. Kunka Á, Lisztes E, Bohács J, Racskó M, Kelemen B, Kovalecz G, et al. TRPA1 up‐regulation mediates oxidative stress in a pulpitis model in vitro. Br J Pharmacol 2024;181(17):3246-62. https://doi.org/10.1111/bph.16386
[DOI] [PubMed]
19. Luo Y, Suttle A, Zhang Q, Wang P, Chen Y. Transient receptor potential (TRP) ion channels in orofacial pain. Mol Neurobiol 2021;58(6):2836-50. https://doi.org/10.1007/s12035-021-02284-2
[DOI] [PubMed] [PMC]
20. Cooper PR, Holder MJ, Smith AJ. Inflammation and regeneration in the dentin-pulp complex: a double-edged sword. J Endod 2014;40(4):S46-S51. https://doi.org/10.1016/j.joen.2014.01.021
[DOI] [PubMed]
21. Orimoto A, Kitamura C, Ono K. 2-hydroxyethyl methacrylate-derived reactive oxygen species stimulate ATP release via TRPA1 in human dental pulp cells. Sci Rep 2022;12(1):12343. https://doi.org/10.1038/s41598-022-16559-8
[DOI] [PubMed] [PMC]
22. Chiu IM, Von Hehn CA, Woolf CJ. Neurogenic inflammation and the peripheral nervous system in host defense and immunopathology. Nat Neurosci 2012;15(8):1063-7. https://doi.org/10.1038/nn.3144
[DOI] [PubMed] [PMC]
23. Pohl S, Akamp T, Smeda M, Uderhardt S, Besold D, Krastl G, et al. Understanding dental pulp inflammation: from signaling to structure. Front Immunol 2024;15:1474466. https://doi.org/10.3389/fimmu.2024.1474466
[DOI] [PubMed] [PMC]
24. Nadhifa TY, Anwaristi AY, Nugrahani NA, Kurniawati D. The effect of coenzim Q10 on the number of lymfocite cells in male wistar rats with periodontitis. Jurnal EduHealt 2023;14(03):1175-84. https://doi.org/10.54209/jurnaleduhealth.v14i3.2621
[DOI]
25. Yoneda T, Tomofuji T, Kawabata Y, Ekuni D, Azuma T, Kataoka K, et al. Application of coenzyme Q10 for accelerating soft tissue wound healing after tooth extraction in rats. Nutrients 2014;6(12):5756-69. https://doi.org/10.3390/nu6125756
[DOI] [PubMed] [PMC]