Si-Young Lee1![]() , Hye-Young Yoon2
, Hye-Young Yoon2![]()
1Department of Microbiology and Immunology, College of Dentistry, Gangneung-Wonju National University
2Department of Dental Hygiene, College of Dentistry, Gangneung-Wonju National University
Correspondence to Hye-Young Yoon, Department of Dental Hygiene, College of Dentistry, Gangneung-Wonju National University, 7 Jukheon-gil, Gangneung-si, 25457, Korea. Tel: +82-33-640-3029, Fax: +82-33-642-6410, E-mail: yoonhy0108@gwnu.ac.kr
Volume 25, Number 1, Pages 25-35, February 2025.
J Korean Soc Dent Hyg 2025;25(1):25-35. https://doi.org/10.13065/jksdh.2025.25.1.3
Received on November 27, 2024, Revised on December 14, 2024, Accepted on December 26, 2024, Published on February 28, 2025.
Copyright © 2025 Journal of Korean Society of Dental Hygiene.
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License(http://creativecommons.org/licenses/by-nc/4.0)
Objectives: The aim of this study was to identify and compare the properties associated with the biofilm-forming abilities of bacteria isolated from water in dental unit waterlines (DUWLs). Methods: Twelve bacterial strains isolated from the output water of DUWLs were cultured in 12-well plates containing polyurethane tubing and R2A medium. The amount of biofilm formed by each strain was evaluated. Based on the amount of biofilm formed, three strains were selected, and the level of adhesion was determined for each strain depending on the inoculation concentration and incubation time. In addition, adhesion inhibitors were identified in the three strains, and their hydrophobicity and extracellular polymeric substances (EPS) formation were compared. Results: Among the 12 strains, the highest levels of biofilm accumulation were seen in Cupriavidus pauculus HY12. C. pauculus HY12 showed higher levels of adhesion at lower bacterial concentrations and shorter incubation times than other strains. The adhesion of C. pauculus HY12 was inhibited by trypsin. Among the three isolates, hydrophobicity and EPS production were the highest in Acidovorax delafieldii HY1. Conclusions: The results of this study provide a basis for understanding the mechanism of DUWL biofilm formation and the development of methods to inhibit biofilm formation.
Bacterial adhesion, Biofilms, Hydrophobicity, Polysaccharide
치과에서 사용하는 유니트 체어 내에는 물 이동을 위해 좁은 지름의 수관이 있다[1]. 많은 연구에서 치과용 유니트 수관(Dental unit waterlines, DUWLs) 내 물이 높은 수준의 미생물로 오염되었다고 확인했다[2,3]. 오염 원인은 진료 시간 외 물의 정체, DUWLs 내 물의 막 흐름(Laminar flow), 좁은 안지름 그리고 DUWLs 내면 바이오필름 등이며, 이 중 DUWLs 바이오필름이 가장 큰 요인으로 보고 있다[1,3,4]. DUWLs 내 물에서 낮은 병원성의 종속영양세균이 주로 검출되지만, 기회 병원성 세균 또한 검출되면서 미생물 오염 관리 중요성이 증가하고 있다[5]. DUWLs 물 내 미생물 오염 수준을 낮춰 환자들에게 안전한 치과 환경을 제공하기 위해서는 바이오필름을 제거하고 형성을 억제해야 한다. 이를 위해서는 DUWLs 바이오필름의 형성 기전을 잘 이해해야 한다.
DUWLs 바이오필름 형성 과정에서 DUWLs에 세균 부착은 가장 중요한 첫 단계이다[6,7]. 즉, 세균의 부착을 억제한다면 바이오필름의 형성 또한 억제할 수 있어서 DUWLs 내면에 세균 부착 억제와 관련된 연구가 수행되고 있다[8]. 세균 부착은 표면 물질과 세균의 부착소 사이 상호작용으로 일어나며 이 부착소의 성질과 세균 부착에 작용하는 다양한 요인들(세균 표면 구조, 소수성 등)에 관한 이해는 예방을 위해 필요하다[7,9,10]. 특히, 소수성(Hydrophobicity)은 세균 부착 능력에 주요 요인으로 알려져 있다[9]. 구강에서 발견되는 일부 미생물을 대상으로 진행된 연구에서 소수성이 높을수록 치아의 획득피막과 협측 상피 세포에 더 잘 부착하는 것으로 밝혔다[10,11].
표면에 부착 후 일부 세균은 세포외다당류(Extracellular polysaccharide, EPS)를 생산하기 시작한다. EPS는 바이오필름의 전체 유기물의 50-90%를 차지하며 바이오필름 내 주요 기질(Matrix) 물질로 여겨진다[6,12]. 또한, EPS는 수소 결합 구조로 많은 물을 합성할 수 있어서 고도로 수화되어 있다[6]. 수화된 EPS는 건조로부터 바이오필름을 보호하며 미생물의 생존에 필요한 여러 물질을 함유하고 있어서 미생물의 생장을 향상한다[12]. 즉, EPS는 바이오필름의 성숙에 중요한 역할을 하고 EPS의 생산으로 추가적인 세균 군집을 가능하게 하며 바이오필름의 두께를 더 두껍게 한다[6].
또한, 바이오필름 부착의 특성과 성숙에 관여하고 EPS를 다량 생산하는 균주를 파악하는 것이 필요하다. 하지만, 현재까지 DUWLs 오염도 및 관리 방법에 관한 연구에 집중되었고, DUWLs에서 분리된 세균의 바이오필름 형성과 관련된 특성에 관한 연구는 이루어지지 않았다.
본 연구에서는 DUWLs 물에서 분리한 균주들의 바이오필름 형성과 특성을 확인하는 것이다. 이를 위해 분리 균주들의 부착, 바이오필름 형성 능력, 소수성, EPS 생산량을 확인하고 비교하고자 한다.
DUWLs로부터 배출되는 물에서 균주를 분리하여 12종의 분리 균주를 대상으로 다양한 소독제에 대한 감수성을 확인한 이전 연구를 참고하여 이 연구에서도 DUWLs로부터 분리하여 -70℃에서 보관 중인 분리 균주 12종을 사용하였다[13]<Table 1>. R2A (Reasoner’s 2A agar) 고체배지(Becton, Dickinson and Company, Sparks, USA)에서 7일 동안 26℃에서 배양한 후 R2A액체배지(Becton, Dickinson and Company)에 대를 이었다[14]. R2A 액체배지에서 배양한 세균액을 실험에 사용하였다.
Table 1. Isolates used to determine the amount of biofilm formation in this study
| Isolates | GenBank | Species match [GenBank accession number] | Homology (%) |
|---|---|---|---|
| HY1 | MG763899 | Acidovorax delafieldii strain PCWCS4 [GQ284437] | 100 |
| HY10 | MG763900 | Brevundimonas subvibrioides ATCC15264 [CP002102] | 99 |
| HY12 | MG763901 | Cupriavidus pauculus strain KPS201 [AM418462] | 100 |
| HY14 | MG763902 | Methylobacterium aquaticum strain GP22 [AJ785571] | 100 |
| HY21 | MG763903 | Microbacterium testaceum strain 38A [KC329834] | 100 |
| HY25 | MG763904 | Novosphingobium fuchskuhlense strain FNE08-7T [KX427098] | 100 |
| HY36 | MG763905 | Pelomonas puraquae strain h18 [KP196829] | 99 |
| HY40 | MG763906 | Polaromonas aquatic strain CCUG39797 [AM039831] | 100 |
| HY47 | MG763907 | Sediminibacterium salmoneum strain SCMC105 [KF358456] | 99 |
| HY49 | MG763908 | Sphingobium xenophagum strain D5AP82 [JF459960] | 100 |
| HY54 | MG763909 | Sphingomonas echinoides strain S32312 [AB649019] | 99 |
| HY70 | MG763910 | Sphingopyxis panaciterrae strain Gsoil164 [AB245354] | 100 |
바이오필름 형성은 기존에 보고된 논문의 방법을 변형하여 실험하였다[15]. R2A 액체 배지에서 배양된 균주를 0.5 McFarland standard (1×108 CFU/mL)와 동등한 혼탁액으로 조정하기 위해 R2A 액체 배지에 현탁하였다. DUWLs로 사용되는 폴리우레탄 튜빙(Polyurethane tubing, 2 mm internal diameter; Nitta Moore Corp., Gumi, South Korea)을 가로 1 cm 그리고 세로로 반으로 잘라 멸균하여 준비하였다. 균주를 멸균한 폴리우레탄 튜빙 조각이 들어있는 12-well plates (SPL, Seoul, South Korea)에서 배양하였다. 12-well plate에 R2A 액체 배지 1.8 mL 와 각 균주의 현탁액 0.2 mL을 추가하였고 26℃에서 7일 동안 교반기(Shaker, Daihan Scientific Corp., Seoul, Korea) 위에서 배양하였다. 배양 후 각 균주로부터 형성된 바이오필름의 양을 확인 및 비교하였다. 실험은 2번 반복하였다.
바이오필름이 형성된 폴리우레탄 튜빙 조각을 12-well plate에서 분리하였고 튜빙의 내면을 제외한 면을 70% 에탄올로 닦아주었다. 그 후 느슨하게 부착된 세균을 제거하기 위해 Phosphate buffered saline (PBS, pH 7.4) 용액에 2번 세척하였다. 그 후 폴리우레탄 튜빙 조각의 내면을 멸균한 periodontal probe로 긁어서 0.09 mm 유리 비드(Sigmund Lindner, Warmensteinach, Germany)를 포함하는 PBS 1 mL에 모았다[2]. 내면을 긁은 후 폴리우레탄 튜빙 조각 시료도 함께 PBS 1 mL에 넣고 와류시켰다. 바이오필름 및 세균을 분리한 용액을 10배수로 희석해 희석액을 R2A 고체배지에 spiral plater (IUL, S.A., Barcelona, Spain)를 이용하여 도말하였다. 도말한 R2A 고체배지는 26℃에서 7일 배양하고 세균 집락을 Colony counter (IUL)로 계수한 후 mL 당 CFU를 계산하여 비교하였다. 이후 진행되는 부착 특성을 확인하기 위한 실험에는 바이오필름 형성 실험 결과에서 높은 바이오필름 형성 능력을 보여준 균주 2종(C. pauculus HY12, A. delafieldii HY1)과 낮은 능력을 보여준 균주 S. xenophagum HY49를 사용하였다.
접종되는 균주의 농도에 따른 균주의 부착량 측정을 위해 R2A 액체 배지에서 성장한 각 균주를 0.5×103, 0.5×105, 0.5×107 그리고 0.5×109 CFU/mL로 희석하여 준비하였다. 24-well plate에 멸균한 폴리우레탄 튜빙 조각을 넣고 농도별로 준비된 각 균주의 현탁액을 3 mL씩 추가하였다. Plate를 26℃, 교반기 위에서 1시간 동안 배양하였다. 배양 후 폴리우레탄 튜빙에 대한 각 균주의 농도별 부착량을 확인 및 비교하였다. 실험은 2번 반복하였다.
배양 시간에 따른 균주의 부착량 측정을 위해 R2A 액체 배지에서 성장한 각 균주를 109 CFU/mL로 조정하였다. 24-well plate의 각 well에 멸균된 폴리우레탄 튜빙 조각을 넣고 균주를 현탁한 현탁액의 3 mL씩을 추가하였다. Plate를 26℃, 교반기 위에서 배양하였다. 배양 후 0.5, 1, 2, 4 그리고 6시간에 폴리우레탄 튜빙에 대한 각 균주의 부착량을 확인 및 비교하였다. 실험은 2번 반복하였다.
폴리우레탄 튜빙 조각에 부착된 균주의 양을 확인하기 위해서 ‘1-3)바이오필름 형성량 확인’ 과정과 동일하게 진행하였다.
부착 억제 실험은 높은 바이오필름 형성 능력을 보여준 C. pauculus HY12와 A. delafieldii HY1에서 확인하였다. 부착소의 성질을 확인하기 위해, 당(Sugar) 및 단백질분해효소인 트립신과 함께 각 세균을 폴리우레탄 튜빙 표면에 부착시킨 후 부착이 억제되는 정도를 확인하였다. 당 처리를 위해 Lactose (Sigma chemicals Co., St. Louis, MO, USA), Glucose (Sigma chemicals Co., St. Louis, MO, USA), Mannose (Sigma chemicals Co., St. Louis, MO, USA), Sucrose (Sigma chemicals Co., St. Louis, MO, USA)를 최종 농도가 33 mg/mL 이 되도록 조정하여 사용하였다[16]. 24-well plate에 멸균한 폴리우레탄 튜빙 조각, 당 그리고 0.5×108 cells/mL로 조정한 균주의 현탁액을 넣고 1시간 동안 부착시킨 후 부착량을 확인 및 비교하였다. 트립신 처리를 위해, 0.5×108 cells/mL로 조정된 균주의 현탁액에 0.5 μg/mL과 10 μg/mL의 트립신(Sigma chemicals Co., St. Louis, MO, USA)을 넣고 30분 동안 처리하였다[17]. 24-well plate에 멸균한 폴리우레탄 튜빙 조각과 트립신으로 처리한 각 균주의 현탁액을 넣고 1시간 동안 부착시킨 후 부착량을 확인 및 비교하였다. 실험은 2번 반복하였다.
소수성 측정은 n-hexadecane에 세균이 흡착될 수 있는 능력을 측정함으로써 결정하였다[18]. R2A 액체배지에서 성장시킨 세균 배양액을 OD550에서 1.0 (1×109 cells/mL)으로 조정하였다. 2 mL의 세균 현탁액(1×109 cells/mL)을 유리 튜브(13 mm)에 넣은 뒤 400 μL의 n-hexadecane (Sigma chemicals Co., St. Louis, MO, USA)을 첨가하고 교반기에서 1분 동안 격렬하게 혼합시켰다. 그런 다음, 상온에서 15분 동안 방치한 후 상층액을 덜어내어 Optical Density (OD)550에서 흡광도를 측정하였다. 소수성(HP)은 다음과 같은 공식을 이용하여 계산하였다.
%HP = [OD(initial)-OD(expt)] × 100 / OD(initial)
여기서 OD(expt)는 n-hexadecane을 첨가하고 15분 방치한 후 측정한 OD550값을 말한다. 실험은 3번 반복하였다.
R2A 액체배지에 배양한 각 세균액 350 μL를 10,000 x g에서 5분간 원심 분리하였다[19]. 원심 분리 후 수용성 세포외다당류(Soluble extracellular polysaccharides, SEPS)를 포함하는 상층액을 새로운 튜브에 모았다. 남겨져 있는 pellet에 1 M NaOH (Sigma chemicals Co., St. Louis, MO, USA) 350 μL를 첨가하고 와류를 준 후 원심분리하였다. 원심분리 후 비수용성 세포외다당류(Insoluble EPS, IEPS)를 포함하는 상층액을 새로운 튜브에 모았다. 남겨져 있는 pellet에 1 M NaOH 350 μL를 첨가하고 와류를 준 후 100℃에서 15분 동안 열처리하였다[20]. 그 후 원심분리하였고 세포내다당류(intracellular polysaccharide, IPS)를 포함하는 상층액을 새로운 튜브에 모았다.
SEPS, IEPS 및 IPS를 포함하는 각 튜브에 3배 부피의 100% ice cold ethanol (Daejung chemicals & metals, Siheung, Korea)을 처리한 후 EPS 침전을 위해서 -20℃에서 30분간 유지하였다[21]. 그런 후 10,000 x g에서 5분간 원심 분리하여 상층액은 버리고 pellet을 얻었다. 이렇게 만들어진 pellet에 70% ethanol로 세척한 후 10,000 x g에서 다시 원심 분리하였으며 이 과정을 2번 반복하였다. 최종적으로 형성된 pellet을 350 μL 1 M NaOH에 재현탁시켰다. 이렇게 얻어진 sample을 Phenol-sulfuric acid method를 통해 EPS양을 측정하였다[22]. 실험은 2번 반복하였다.
자료분석은 IBM SPSS Program (ver. 28.0; IBM Corp., Armonk, NY, USA)을 통해 시행되었다. 억제처리 물질(당, 단백질분해효소) 간 부착 정도를 비교하기 위해 그리고 분리 균주 간 소수성을 비교하기 위해 Kruskal–Wallis test를 시행하였으며, 사후검정은 Duncan test를 실시하였다. 유의수준은 0.05 범위에서 통계학적 유의성을 검증하였다.
각 분리 균주의 바이오필름 형성량은 <Fig. 1>과 같다. C. pauculus HY12가 가장 많은 바이오필름 형성량을 보여주었고, 그 다음으로 P. aquatica HY40와 A. delafieldii HY1 순으로 많았으며, M. aquaticum HY14와 S. xenophagum HY49 순으로 가장 적은 축적량을 보여주었다.
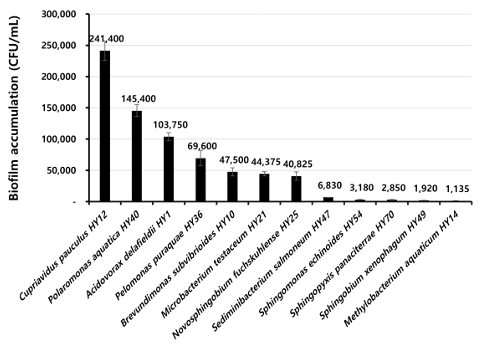
Fig. 1. Biofilm accumulation of each isolate formed in polyurethane tubes over 7 days. Black bars represent the mean of the CFU/mL the duplicate polyurethane tubes. Standard deviations are indicated by vertical lines.
대상 균주를 0.5×103 CFU/mL로 접종하였을 때, 부착량은 없었다<Fig. 2a>. 0.5×105 CFU/mL 로 접종하였을 경우, C. pauculus HY12의 부착량은 50 CFU/mL이었고, A. delafieldii HY1와 S. xenophagum HY49의 부착량은 없었다. 0.5×109 CFU/mL 로 접종 시, C. pauculus HY12 (290,667±82,637 CFU/mL)와 A. delafieldii HY1 (69,800±43,774 CFU/mL)의 부착량은 S. xenophagum HY49 (14,997 CFU/ml±4,056 CFU/mL)의 부착량에 비해 약 19배 그리고 4배 더 많았다.
C. pauculus HY12와 A. delafieldii HY1의 부착량은 배양 시간이 증가함에 따라 부착량도 증가하였고, S. xenophagum HY49의 부착량은 배양 2시간까지 증가하다가 그 이후의 배양 시간에서는 부착량이 감소하였다<Fig. 2b>. 모든 배양 시간에서 C. pauculus HY12와 A. delafieldii HY1의 부착량이 S. xenophagum HY49의 부착량보다 많았다.
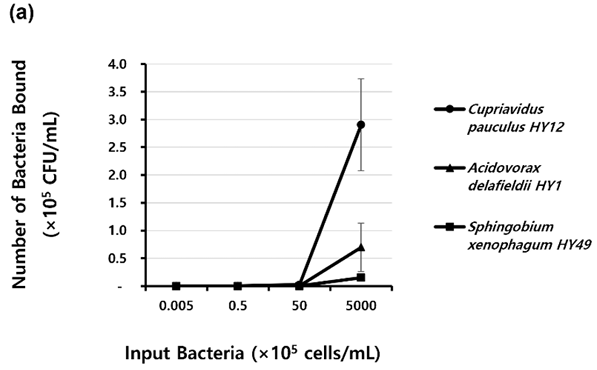
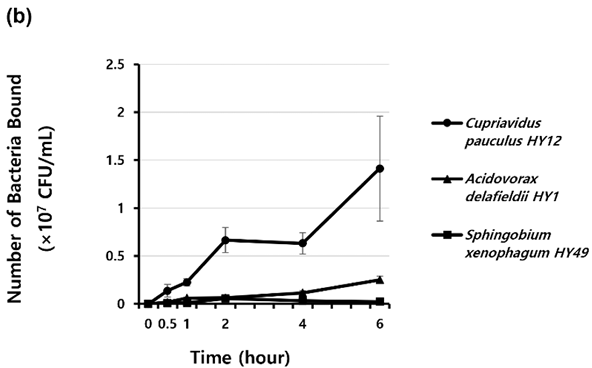
Fig. 2. Binding of isolated strains in polyurethane tubes according to the (a) inoculated concentration and (b) time. Black points represent the mean of the CFU/mL for the duplicate polyurethane tubes. Standard deviations are indicated by vertical lines.
C. pauculu HY12의 경우, 당에 의해 부착이 억제되지 않았고, 트립신에 의해 부착이 억제되었다. 특히, 0.5 μg/mL 트립신에 처리된 균주의 부착률은 47.4%로 가장 낮았다<Fig. 3>. 0.5 μg/mL 트립신 첨가 후 부착률과 당 첨가 후 부착률 사이에는 통계적으로 유의한 차이가 나타났다(p<0.05).
A. delafieldii HY1의 경우, glucose와 10 μg/mL 트립신을 제외한 모든 억제제(Inhibitor)에 의해 부착이 억제되었다. Mannose 첨가 후, 부착률은 5.8%로 가장 낮았다<Fig. 3>. Mannose 첨가 후 부착률과 glucose와 10 μg/mL 트립신 첨가 후 부착률 사이에는 각각 통계적으로 유의한 차이가 나타났다(p<0.05, p<0.01).
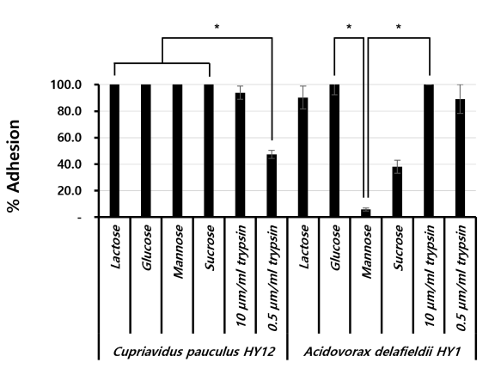
Fig. 3. Effect of various treatment of isolated strains on binding to polyurethane tubes. Black bars represent the mean for % adhesion from CFU/mL for the duplicate polyurethane tubes. Standard deviations are indicated by vertical lines. *p<0.05
C. pauculus HY12와 A. delafieldii HY1의 소수성은 S. xenophagum HY49의 소수성보다 높았다<Fig. 4>. 3종의 균주 중 가장 높은 소수성을 가진 균주는 A. delafieldii HY1였다. A. delafieldii HY1와 S. xenophagum HY49의 소수성은 통계적으로 유의한 차이가 있었다(p<0.01).
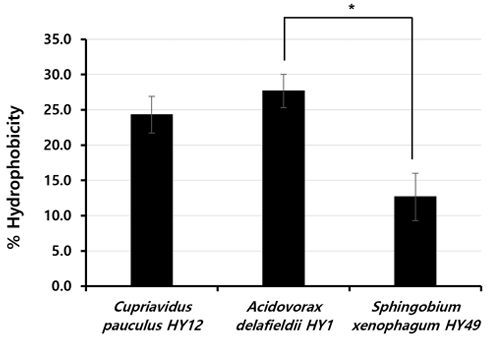
Fig. 4. Hydrophobicity of isolated strains. Black bars represent the mean of three experiments. Standard deviations are indicated by vertical lines. *p<0.05
3종의 균주의 SEPS, IEPS 그리고 IPS의 양은 <Fig. 5>에 나타냈다. 3종의 분리 균주 중 가장 많은 SEPS를 생산한 균주는 A. delafieldii HY1 (144 μg/mL±6 μg/mL)이었고, C. pauculus HY12 (89 μg/mL±19 μg/mL)와 S. xenophagum HY49 (86 μg/mL±24 μg/mL) 이 생산한 SEPS의 양은 유사하였다<Fig. 5a>. IEPS와 IPS도 마찬가지로 A. delafieldii HY1 가 가장 많이 생산하였다<Fig. 5b,c>.
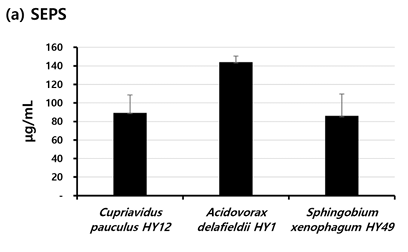
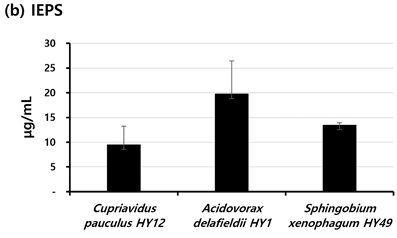
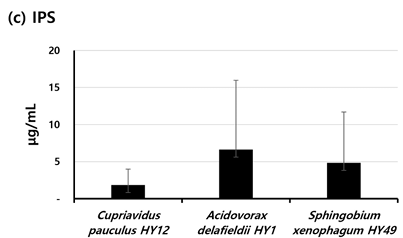
Fig. 5. Average amount of soluble (SEPS) and insoluble (IEPS) extracellular and intracellular (IPS) polysaccharides of each isolate. Black bars represent the mean of the μg/mL for the duplicate polyurethane tubes. Standard deviations are indicated by vertical lines.
이 연구는 DUWLs로부터 분리한 균주를 대상으로 바이오필름 형성에 영향을 미치는 특성을 확인하기 위해 시행되었다. 바이오필름은 표면과 세균의 부착, 세균 간 응집, 세포외다당류의 결합 과정을 거치면서 성숙된다[6]. 바이오필름의 성숙 단계별로 주요한 역할을 하는 세균에 대해 밝혀진다면 그 세균의 성장을 억제하면서 바이오필름의 성숙을 억제할 수 있다.
물질의 표면에 대한 세균의 부착은 바이오필름 형성 및 성숙 단계에서 가장 첫 단계에 해당하며 중요한 단계이다[6,7]. Simoes 등[7]은 음용수에서 분리한 균주의 Polystyrene 표면에 대한 부착 능력이 높을수록 바이오필름 형성 능력 또한 높은 것을 확인하였다. 이에 우리의 연구에서는 대표적인 DUWLs의 재질인 폴리우레탄에 대한 DUWLs로부터 분리한 12종의 균주들의 바이오필름 형성 능력을 비교하고자 하였다. 우리의 이전 연구에서 DUWLs의 소독제로 사용되는 화학물질에 대한 분리 균주의 감수성을 확인하기 위해 DUWLs에서 배출되는 물로부터 12속(Genus), 31종(Species)의 균주를 분리하였고, 속별로 1종씩 선택하여 12종의 균주를 대상으로 실험을 수행하였다[13]. 현 연구에서도 같은 12종의 균주를 대상으로 실험을 수행하였다. 그 결과 분리균주 12종 중 Cupriavidus pauculus HY12가 가장 높은 바이오필름 형성 능력을 보여주었고, Polaromonas aquatic HY40, 그리고 Acidovorax delafieldii HY1 순서로 바이오필름 형성 능력이 높았다. 또한, C. pauculus HY12의 경우 낮은 농도로 존재하거나 짧은 배양 시간에서도 다른 균주들에 비해 부착량 또한 많았다. 세균의 부착에는 소수성 또한 영향을 미치는 것으로 알려져 있어서, 바이오필름 형성 능력을 토대로 일부 균주를 선별하여 소수성을 확인하였다[9]. 그 결과, A. delafieldii HY1 과 C. pauculus HY12의 소수성이 각각 평균 27.7%, 24.3%로 유사했으며, 바이오필름 형성 능력이 낮았던 Sphingobium xenophagum HY49의 소수성에 비해서 높았다. 세균이 다른 세균 또는 물질의 표면에 부착하여 바이오필름을 형성하는 데 부착소와 협막(Capsule)의 존재 그리고 표면 소수성은 중요한 역할을 한다[10]. 마찬가지로 분리 균주의 바이오필름 형성 능력에 소수성이 영향을 미쳤을 수 있다.
Han 등[16]은 구강 상피 세포에 대한 Fusobacterium nucleatum의 부착 성질을 확인하기 위해 다양한 당으로 처리 후 부착의 억제 정도를 확인하였다. 그 결과, galactose 함유 당에 의해 크게 부착이 억제되었기 때문에 galactose 결합 부착소가 표면 부착에 관여할 것으로 제안하였다. 이 연구에서도 폴리우레탄 표면에 대한 분리 균주의 부착 성질을 확인하기 위해 다양한 당을 포함하여 트립신 처리 후 부착 억제 정도를 확인하였다. C. pauculus HY12의 경우 트립신에 의해 부착이 억제되었으므로 C. pauculus HY12의 폴리우레탄에 대한 부착은 단백질 부착소와 수용체 사이 상호작용에 의해 매개되는 것으로 보인다.
세균의 부착에는 소수성뿐만 아니라 세균이 생산해 내는 세포외다당류(EPS)도 영향을 줄 수 있는 것으로 알려져 있다[7,10]. 이러한 이유로 소수성을 확인한 일부 분리균주를 대상으로 EPS의 양을 확인하였다. 구강 세균 중에 하나인 S. mutans가 생산해 내는 다당류를 예로 수용성 세포외다당류(SEPS)는 바이오필름 발달 및 축적에 중요한 역할을 하는 것으로 알려져 있으며, 비수용성 세포외다당류(IEPS)는 표면의 부착과 집락에 결정적인 역할을 하는 것으로 알려져 있다[23]. 그리고 세포내다당류(IPS)는 산 생산을 위한 중요한 근원으로 알려져 있다[23]. 일부 DUWLs 분리균주를 대상으로 EPS의 종류별 생산량을 확인하였을 때, A. delafieldii HY1가 가장 생산량이 많았다. 부착과 바이오필름 형성에 영향을 주는 세균의 특성을 DUWLs 분리균주를 대상으로 확인하여 그 결과에 대해 종합적으로 보면, A. delafieldii HY1가 표면에 대한 부착과 DUWLs 바이오필름 형성에 중요한 역할을 할 수 있을 것으로 사료된다. EPS는 바이오필름의 제거에도 고려되는 균주의 특성으로 여겨진다[24]. Azeredo와 Oliveira[24]는 많은 양의 EPS를 생산한 균주가 형성한 바이오필름이 적은 양의 EPS를 생산한 균주가 형성한 바이오필름보다 제거하기 어려우며 이는 EPS에 의해 바이오필름 내 결합력이 더 높아졌기 때문이라고 제안하였다. 그래서 바이오필름의 안정성과 제거도 바이오필름을 구성하는 세균의 EPS 생산은 중요하다고 할 수 있다. 바이오필름 형성을 억제하는 효율적인 방법의 개발에 있어서 일부 연구자들은 바이오필름을 구성하는 세균 중 EPS 생산 능력이 높은 균주의 EPS 생산 능력을 감소시키는 물질의 활용을 제안하고 있다[23,25,26]. 구강 바이오필름의 형성을 억제하는 새로운 방법의 개발을 위해 세균 중 높은 EPS 생산 능력을 가진 S. mutans가 생산하는 EPS를 대상으로 새로운 물질의 항바이오필름 능력을 확인하였다[23,25]. 이와 같은 연구에서처럼, DUWLs 바이오필름 형성을 억제하기 위한 새로운 방법으로 EPS의 생산을 감소시키는 방법이 활용될 수 있으며, 대상이 되는 EPS로는 이 연구 결과에서 높은 EPS 생산 능력을 가진 A. delafieldii HY1가 생산하는 EPS가 될 수 있다. 유사하게 표면에 대한 세균의 부착을 억제하면서 바이오필름 형성을 예방하는 방법의 개발이 이루어지고 있다[8]. 이 연구에서 밝혀진 표면에 대한 부착 능력이 높은 것으로 사료되는 C. pauculus HY12와 A. delafieldii HY1의 부착을 효율적으로 억제할 수 있는 물질은 DUWLs 바이오필름 형성을 억제하기위해 활용될 수 있을 것이다.
C. pauculus 는 면역력이 저하된 사람에게 균혈증, 패혈증, 복막염과 같은 질병을 유발할 수 있는 것으로 보고되었으며, 대부분의 경우에서 이 세균의 근원에 대해서 밝혀지지 않았지만, 일부에서는 오염된 물로 밝혀졌다[27]. 따라서, C. pauculus을 억제하는 물질의 사용은 바이오필름 형성 억제와 함께 오염된 물로 인한 교차 감염 또한 예방할 수 있을 것이다.
최근 High-throughput DNA sequencing 기술을 사용하여 DUWLs 내 총 63-394 속(Genus)의 다양한 세균이 존재하는 것을 확인하였다[28,29]. 우리의 연구는 DUWLs에서 분리된 12종의 균주를 대상으로 연구를 진행하였다는 것에서 제한을 가진다. 또한, 우리의 연구에서 분리균주의 바이오필름 형성 능력을 전자현미경 또는 콘포칼 현미경을 통해 분리균주가 형성시킨 바이오필름의 형태와 두께를 함께 확인하지 못했다는 한계를 가진다[15,30]. 따라서, 이러한 한계점을 보완하여 더 많은 분리균주를 대상으로 부착 및 바이오필름 형성과 관련된 특성을 현미경 관찰과 함께 확인하고 비교하는 연구를 진행할 필요가 있다.
그리고 세균의 부착에는 소수성과 세포외다당류와 함께 세균 표면의 전하, 선모(Pili)와 편모(Flagella)와 같은 세균 표면의 구조 등 다양한 요인이 영향을 줄 수 있다[7,10]. 추후에는 분리균주에 대한 이와 같은 특징에 대해서도 추가로 조사될 필요가 있다.
이 연구의 결과는 DUWLs 바이오필름의 형성 과정을 이해하는 데 도움을 줄 수 있으며, 나아가 DUWLs 바이오필름의 형성을 예방하고 제거하는 방법의 개발을 위한 기초자료로 활용될 수 있을 것이다.
이 연구는 DUWLs에서 배출한 물에서 분리한 균주들의 부착 및 바이오필름 형성 능력을 확인 및 비교하고, 분리 균주들의 소수성과 EPS 생산량을 확인 및 비교하기 위한 목적으로 시행되었다.
1. DUWLs 로부터 분리한 12종의 균주를 대상으로 바이오필름 형성량을 확인하였을 때, C. pauculus HY12가 가장 많은 바이오필름 형성량을 보여주었고, 그다음으로 P. aquatica HY40와 A. delafieldii HY1 순으로 바이오필름 형성량이 많았다. 그리고 M. aquaticum HY14 와 S. xenophagum HY49 순으로 가장 적은 바이오필름 축적량을 보여주었다.
2. S. xenophagum HY49 에 비해 C. pauculus HY12와 A. delafieldii HY1가 낮은 농도 그리고 짧은 배양 시간에서도 폴리우레탄에 대한 부착량이 많았고, C. pauculus HY12는 트립신에 의해 부착이 억제되었으며, A. delafieldii HY1는 Mannose에 의해 부착이 가장 많이 억제되었다.
3. 소수성은 A. delafieldii HY1에서 가장 높았으며, EPS 생산량도 A. delafieldii HY1에서 가장 많았다.
따라서, 표면에 대한 부착 및 바이오필름 형성에서 A. delafieldii HY1와 C. pauculus HY12가 주요한 역할을 할 가능성이 있으며, 본 연구의 결과는 DUWLs 바이오필름의 형성 기전을 이해하고, 형성을 억제하는 방법의 개발을 위한 기초 자료를 제공한다.
Conceptualization: GC Youn, HE Cho; Data collection: GC Youn, HE Cho; Formal analysis: GC Youn, HE Cho; Writing-original draft: GC Youn, HE Cho; Writing-review&editing: GC Youn, HE Cho
The authors declared no conflicts of interest.
None.
This study was approved by the Institutional Review Board (IRB) of Kwangju Women’s University (IRB No. 1041485-202007-HR001-28).
Data can be obtained from the corresponding author.
This article is based on a part of the first author’s master’s thesis from Kwangju Women’s University.
Conceptualization: HY Yoon, SY Lee; Data collection: HY Yoon, SY Lee; Formal analysis: HY Yoon, SY Lee; Writing-original draft: SY Lee; Writing-review&editing: HY Yoon, SY Lee
The authors declared no conflicts of interest.
None.
Non-human or animal research.
Please contact the corresponding author for data availability.
None.
1. O’Donnell MJ, Boyle MA, Russell RJ, Coleman DC. Management of dental unit waterline biofilms in the 21st century. Future Microbiol 2011;6(10):1209-26. https://doi.org/10.2217/fmb.11.104
[DOI][PubMed]
2. Walker JT, Bradshaw DJ, Bennett AM, Fulford MR, Martin MV, Marsh PD. Microbial biofilm formation and contamination of dental-unit water systems in general dental practice. Appl Environ Microbiol 2000;66(8):3363-7. https://doi.org/10.1128/AEM.66.8.3363-3367.2000
[DOI][PubMed][PMC]
3. Kohn WG, Harte JA, Malvitz DM, Collins AS, Cleveland JL, Eklund KJ, et al. Guidelines for infection control in dental health care settings-2003. J Am Dent Assoc 2004;135(1):33-47. https://doi.org/10.14219/jada.archive.2004.0019
[DOI][PubMed]
4. Whitehouse RL, Peters E, Lizotte J, Lilge C. Influence of biofilms on microbial contamination in dental unit water. J Dent 1991;19(5):290-5. https://doi.org/10.1016/0300-5712(91)90075-A
[DOI][PubMed]
5. Szymanska J, Sitkowska J. Opportunistic bacteria in dental unit waterlines: assessment and characteristics. Future Microbiol 2013;8(5):681-9. https://doi.org/10.2217/fmb.13.33
[DOI][PubMed]
6. Walker JT, Marsh PD. Microbial biofilm formation in DUWS and their control using disinfectants. J Dent 2007;35(9):721-30. https://doi.org/10.1016/j.jdent.2007.07.005
[DOI][PubMed]
7. Simoes LC, Simoes M, Vieira MJ. Adhesion and biofilm formation on polystyrene by drinking water-isolated bacteria. Antonie Van Leeuwenhoek 2010;98(3):317-29. https://doi.org/10.1007/s10482-010-9444-2
[DOI][PubMed]
8. Yabune T, Imazato S, Ebisu S. Assessment of inhibitory effects of fluoride-coated tubes on biofilm formation by using the in vitro dental unit waterline biofilm model. Appl Environ Microbiol 2008;74(19):5958-64. https://doi.org/10.1128/AEM.00610-08
[DOI][PubMed][PMC]
9. Simoes LC, Simoes M, Oliveira R, Vieira MJ. Potential of the adhesion of bacteria isolated from drinking water to materials. J Basic Microbiol 2007;47(2):174-83. https://doi.org/10.1002/jobm.200610224
[DOI][PubMed]
10. Basson A, Flemming LA, Chenia HY. Evaluation of adherence, hydrophobicity, aggregation, and biofilm development of Flavobacterium johnsoniae-like isolates. Microb Ecol 2008;55(1):1-14. https://doi.org/10.1007/s00248-007-9245-y
[DOI][PubMed]
11. Ellepola AN, Samaranayake LP. The effect of limited exposure to antimycotics on the relative cell-surface hydrophobicity and the adhesion of oral Candida albicans to buccal epithelial cells. Arch Oral Biol 1998;43(11):879-87. https://doi.org/10.1016/S0003-9969(98)00064-8
[DOI][PubMed]
12. Donlan RM. Biofilms: microbial life on surfaces. Emerg Infect Dis 2002;8(9):881-90. https://doi.org/10.3201/eid0809.020063
[DOI][PubMed][PMC]
13. Yoon HY, Lee SY. Susceptibility of bacteria isolated from dental unit waterlines to disinfecting chemical agents. J Gen Appl Microbiol 2019;64(6):269-75. https://doi.org/10.2323/jgam.2018.02.001
[DOI][PubMed]
14. Reasoner DJ. Heterotrophic plate count methodology in the United States. Int J Food Microbiol 2004;92(3):307-15. https://doi.org/10.1016/j.ijfoodmicro.2003.08.008
[DOI][PubMed]
15. Park JH, Lee JK, Um HS, Chang BS, Lee SY. A periodontitis-associated multispecies model of an oral biofilm. J Periodontal Implant Sci 2014;44(2):79-84. https://doi.org/10.5051/jpis.2014.44.2.79
[DOI][PubMed][PMC]
16. Han YW, Shi W, Huang GT, Haake SK, Park NH, Kuramitsu H, et al. Interactions between periodontal bacteria and human oral epithelial cells: Fusobacterium nucleatum adheres to and invades epithelial cells. Infect Immun 2000;68(6):3140-6. https://doi.org/10.1128/IAI.68.6.3140-3146.2000
[DOI][PubMed][PMC]
17. Lee SY, Kim KK, Choe SJ. Binding of oral streptococci to human fibrinogen. Oral Microbiol Immunol 2001;16(2):88-93. https://doi.org/10.1034/j.1399-302x.2001.016002088.x
[DOI][PubMed]
18. Kim KK, Lee SY, Kim YJ, Choe SJ. Effects of subinhibitory antibiotic concentrations on Porphyromonas gingivalis fibrinogen and hemin binding. Int J Oral Biol 1999;24(3):121-7.
19. Cury JA, Rebello MA, Del Bel Cury AA. In situ relationship between sucrose exposure and the composition of dental plaque. Caries Res 1997;31(4):356-60. https://doi.org/10.1159/000262418
[DOI][PubMed]
20. Tenuta LM, Ricomini Filho AP, Del Bel Cury AA, Cury JA. Effect of sucrose on the selection of mutans streptococci and lactobacilli in dental biofilm formed in situ. Caries Res 2006;40(6):546-9. https://doi.org/10.1159/000095656
[DOI][PubMed]
21. Aires CP, Del Bel Cury AA, Tenuta LM, Klein MI, Koo H, Duarte S, et al. Effect of starch and sucrose on dental biofilm formation and on root dentine demineralization. Caries Res 2008;42(5):380-6. https://doi.org/10.1159/000154783
[DOI][PubMed]
22. DuBois M, Gilles KA, Hamilton JK, Rebers Pt, Smith F. Colorimetric method for determination of sugars and related substances. Analytical chemistry 1956;28(3):350-6. https://doi.org/10.1021/ac60111a017
[DOI]
23. Koo H, Hayacibara MF, Schobel BD, Cury JA, Rosalen PL, Park YK, et al. Inhibition of Streptococcus mutans biofilm accumulation and polysaccharide production by apigenin and tt-farnesol. J Antimicrob Chemother 2003;52(5):782-9. https://doi.org/10.1093/jac/dkg449
[DOI][PubMed]
24. Azeredo J, Oliveira R. The role of exopolymers produced by Sphingomonas paucimobilis in biofilm formation and composition. Biofouling 2000;16(1):17-27. https://doi.org/10.1080/08927010009378427
[DOI]
25. Senpuku H, Tuna EB, Nagasawa R, Nakao R, Ohnishi M. The inhibitory effects of polypyrrole on the biofilm formation of Streptococcus mutans. PLoS One 2019;14(11):e0225584. https://doi.org/10.1371/journal.pone.0225584
[DOI][PubMed][PMC]
26. Huang CT, Stewart PS. Reduction of polysaccharide production in Pseudomonas aeruginosa biofilms by bismuth dimercaprol (BisBAL) treatment. J Antimicrob Chemother 1999;44(5):601-5. https://doi.org/10.1093/jac/44.5.601
[DOI][PubMed]
27. Balada-Llasat JM, Elkins C, Swyers L, Bannerman T, Pancholi P. Pseudo-outbreak of Cupriavidus pauculus infection at an outpatient clinic related to rinsing culturette swabs in tap water. J Clin Microbiol 2010;48(7):2645-7. https://doi.org/10.1128/JCM.01874-09
[DOI][PubMed][PMC]
28. Costa D, Mercier A, Gravouil K, Lesobre J, Delafont V, Bousseau A, et al. Pyrosequencing analysis of bacterial diversity in dental unit waterlines. Water Res 2015;81:223-31. https://doi.org/10.1016/j.watres.2015.05.065
[DOI][PubMed]
29. Zhang Y, Ping Y, Zhou R, Wang J, Zhang G. High throughput sequencing-based analysis of microbial diversity in dental unit waterlines supports the importance of providing safe water for clinical use. J Infect Public Health 2018;11(3):357-63. https://doi.org/10.1016/j.jiph.2017.09.017
[DOI][PubMed]
30. Steiger EL, Muelli JR, Braissant O, Waltimo T, Astasov-Frauenhoffer M. Effect of divalent ions on cariogenic biofilm formation. BMC Microbiol 2020;20(1):287. https://doi.org/10.1186/s12866-020-01973-7
[DOI][PubMed][PMC]